感染症の一種である原虫感染症とは単細胞の真核生物である原虫が人体に侵入して引き起こす疾患群を指します。
原虫(げんちゅう)は細菌やウイルスとは異なる特徴を持つ微生物で、より複雑な構造と生活環を有しています。
これらの微生物は主に汚染された水や食物、あるいは媒介生物を通じて人体に侵入して様々な健康問題を引き起こす可能性があります。
原虫感染症は世界中で発生しており特に衛生状態の悪い地域で深刻な影響を及ぼしています。
代表的な原虫感染症にはマラリアやアメーバ赤痢などがあり、それぞれ特有の症状や経過を示します。
原虫感染症の病型:多様な分類と特徴
原虫感染症は多岐にわたる病型を持ちその特徴は原虫の種類や感染部位によって大きく異なります。
各病型の特徴を把握して理解することは効果的な予防法や感染症対策において大切です。
また原虫感染症の病型に関する知識は新たな感染症の出現や流行を予測する上でも重要な役割を果たします。
ここでは原虫感染症の主要な病型について詳しく解説します。
原虫感染症の基本的な分類
原虫感染症はその原因となる原虫の生態や構造に基づいて複数のグループに分類されます。
これらの分類は原虫感染症の特性を理解する上で重要な役割を果たしています。
原虫感染症の主な分類は以下の通りです。
- 鞭毛虫類感染症
- アメーバ感染症
- 胞子虫類感染症
- 繊毛虫類感染症
各グループはそれぞれ独自の特徴を持ち人体に与える影響も異なります。
鞭毛虫類感染症の特徴と代表的な疾患
鞭毛虫類感染症は鞭毛を持つ原虫によって引き起こされる感染症のグループです。
この鞭毛は原虫の運動に使われ効率的な移動を可能にすることで感染を広げる一因です。
代表的な鞭毛虫類感染症にはトリコモナス症・アフリカトリパノソーマ症・ランブル鞭毛虫症などが含まれます。
これらの感染症は人体の様々な部位に影響を与えて特有の病態を引き起こすことがあります。
| 鞭毛虫類感染症 | 主な感染部位 |
| トリコモナス症 | 泌尿生殖器 |
| アフリカトリパノソーマ症 | 血液・リンパ系 |
| ランブル鞭毛虫症 | 小腸 |
鞭毛虫類感染症の中には熱帯地域特有のものも存在し地理的な分布にも特徴があります。
アメーバ感染症の特徴と代表的な疾患
アメーバ感染症は形を変えながら移動する特徴的な原虫によって引き起こされる感染症のグループです。
この変形能力によりアメーバ類は人体内で効果的に移動して増殖することができます。
代表的なアメーバ感染症は赤痢アメーバ症・大腸アメーバ症・自由生活性アメーバ症などです。
これらの感染症は主に消化器系に影響を与えますが中には他の臓器にも侵入するものもあります。
アメーバ感染症の中には環境中に広く分布し日和見感染を起こすものもあります。
このような特性によりアメーバ感染症は世界中で発生し公衆衛生上の課題となっています。
胞子虫類感染症の特徴と代表的な疾患
胞子虫類感染症は複雑な生活環を持つ原虫によって引き起こされる感染症のグループです。
この生活環には宿主内での無性生殖と有性生殖の両方が含まれることが多いという特徴があります。
代表的な胞子虫類感染症はクリプトスポリジウム症・トキソプラズマ症・マラリアなどです。
これらの感染症は様々な経路で人体に侵入して重篤な病態を引き起こす可能性があります。
| 胞子虫類感染症 | 主な感染経路 |
| クリプトスポリジウム症 | 水系感染 |
| トキソプラズマ症 | 食物・動物接触 |
| マラリア | 蚊媒介 |
胞子虫類感染症の中には免疫不全者に特に危険なものもあり医療現場での注意が必要です。
繊毛虫類感染症の特徴と代表的な疾患
繊毛虫類感染症は体表面に多数の繊毛を持つ原虫によって引き起こされる感染症のグループです。
この繊毛は運動や摂食に使われ繊毛虫類の生存に不可欠な役割を果たしています。
人体に感染する代表的な繊毛虫類感染症はバランチジウム症です。
バランチジウム症は主に大腸に影響を与え消化器系の問題を引き起こすことがあります。
繊毛虫類の中には環境中で自由生活を送るものも多く生態系の中で重要な位置を占めているのです。
人体に感染する繊毛虫類感染症は比較的少ないですがその影響は軽視できません。
原虫感染症の病型は以下のような要因によって更に細分化されることがあります。
| 分類基準 | 例 |
| 宿主特異性 | 単一宿主型・複数宿主型 |
| 感染部位 | 腸管寄生・血液寄生 |
| 生活環の複雑さ | 単純型・複雑型 |
| 病原性の強さ | 強毒株・弱毒株 |
これらの要因を考慮することでより詳細な病型分類が可能となり診断や対策に役立ちます。

原虫感染症の主症状
原虫感染症は多岐にわたる症状を呈し、その臨床像は原虫の種類や感染部位によって大きく異なります。
感染初期には軽微であったり非特異的であったりすることもあるため注意深い経過観察が重要です。
また免疫状態・既往歴・居住地域などの個人差によって症状の現れ方や重症度が異なる可能性があります。
本稿では原虫感染症の主要な症状について詳しく解説します。
消化器系の症状
原虫感染症の中でも特に消化器系に影響を与えるものが多く見られます。
これらの感染症では下痢・腹痛・嘔吐といった症状が現れるのが共通点です。
例えばランブル鞭毛虫症では慢性的な下痢・腹部不快感・体重減少などが主な症状となります。
一方赤痢アメーバ症では血便を伴う激しい下痢が特徴的です。
これらの症状は感染した原虫が腸管内で増殖して粘膜に損傷を与えることで引き起こされます。
| 感染症 | 主な消化器症状 |
| ランブル鞭毛虫症 | 慢性下痢・腹部不快感 |
| 赤痢アメーバ症 | 血便・激しい下痢 |
| クリプトスポリジウム症 | 水様性下痢・腹痛 |
消化器系の症状は患者さんの栄養状態や日常生活に大きな影響を与える可能性があるため注意が必要です。
全身性の症状
一部の原虫感染症では全身に及ぶ症状が現れることがあります。
これらの症状は原虫が血流に乗って体内を移動したり免疫反応を引き起こしたりすることで生じます。
代表的な全身性症状は次のようなものです。
- 発熱
- 倦怠感
- 筋肉痛
- 頭痛
- リンパ節腫脹
例えばマラリアでは周期的な高熱と悪寒が特徴的な症状として知られています。
トキソプラズマ症ではインフルエンザ様の症状が現れることがあり発熱や筋肉痛、倦怠感などが見られます。
これらの全身症状は他の感染症とも共通する部分があるため正確な診断には専門医による詳細な検査が重要です。
皮膚・粘膜の症状
一部の原虫感染症では皮膚や粘膜に特徴的な症状が現れることがあります。
これらの症状は原虫が直接皮膚や粘膜に感染したり全身性の反応として現れたりします。
以下は原虫感染症の皮膚・粘膜症状例です。
- 発疹
- かゆみ
- 潰瘍
- 粘膜の炎症
例えばリーシュマニア症では皮膚に特徴的な潰瘍が形成されることがあります。
トリコモナス症では泌尿生殖器の粘膜に炎症が起こり、不快感やかゆみを引き起こすケースもあります。
| 感染症 | 主な皮膚・粘膜症状 |
| リーシュマニア症 | 皮膚潰瘍 |
| トリコモナス症 | 粘膜炎症・かゆみ |
| アフリカトリパノソーマ症 | 一過性の発疹 |
これらの症状は患者さんの生活の質に直接影響を与えるため早期の発見と対応が大切です。
神経系の症状
一部の原虫感染症では神経系に影響を与えて様々な神経学的症状を引き起こすことがあります。
これらの症状は原虫が直接中枢神経系に侵入したり神経組織に炎症を引き起こしたりすることで生じます。
以下は報告されている神経系の症状です。
- 頭痛
- めまい
- 意識障害
- 痙攣
- 麻痺
例えばアフリカトリパノソーマ症では進行すると睡眠障害や意識レベルの変化が現れることがあります。
トキソプラズマ症が中枢神経系に影響を与えると頭痛や痙攣 神経障害などの症状が現れる可能性があります。
| 感染症 | 主な神経系症状 |
| アフリカトリパノソーマ症 | 睡眠障害・意識障害 |
| トキソプラズマ症 | 頭痛・痙攣 |
| 脳マラリア | 昏睡・痙攣 |
神経系の症状は患者さんの生命に関わる重大な問題につながる恐れがあるため迅速な対応が不可欠です。
2019年にLancet Infectious Diseasesに掲載された研究では熱帯地域における原虫感染症の神経系合併症の発生率は予想以上に高く、特に小児に深刻な影響を与えていることが報告されています。
この研究結果は原虫感染症の診断と管理において神経系症状への注意が重要であることを示唆しています。

原虫感染症の原因とリスク因子
原虫感染症は様々な経路で人体に侵入する微生物によって引き起こされます。
複雑な要因が絡み合って発生するためその予防や管理には多面的なアプローチが必要です。
本項では原虫感染症の主な原因や感染のきっかけとなる要因について詳しく解説します。
水や食物を介した感染
多くの原虫感染症は汚染された水や食物を摂取することで引き起こされます。
この感染経路は特に衛生状態の悪い地域や途上国において顕著です。
原虫は非常に小さく、通常の浄水処理では完全に除去できないことがあるため水を介した感染のリスクが高くなります。
例えばクリプトスポリジウム症は汚染された水を飲むことで感染する代表的な原虫感染症です。
| 原虫感染症 | 主な感染源 |
| クリプトスポリジウム症 | 汚染された水 |
| ジアルジア症 | 汚染された水や食物 |
| アメーバ赤痢 | 汚染された水や食物 |
食物を介した感染では生や加熱不十分な食品、特に野菜や果物が感染源となることがあります。
これらの食品表面に付着した原虫が洗浄不足や不適切な調理により体内に入り込む可能性があります。
媒介生物による感染
一部の原虫感染症は蚊やハエなどの媒介生物を通じて人体に侵入します。
これらの媒介生物は原虫を保有しており、人間を刺すことで感染を引き起こすのです。
代表的な例としてマラリアが挙げられ、これはハマダラカに刺されることで感染します。
媒介生物による感染は特に熱帯や亜熱帯地域で多く見られ、気候変動の影響により感染地域が拡大する可能性があります。
以下は媒介生物による主な原虫感染症です。
- マラリア(ハマダラカ)
- リーシュマニア症(サシチョウバエ)
- アフリカトリパノソーマ症(ツェツェバエ)
- シャーガス病(サシガメ)
これらの感染症は媒介生物の生息地や活動時期と密接に関連していて地理的・季節的な特徴を持っています。
人から人への直接感染
一部の原虫感染症では人から人への直接的な感染が起こることがあり、これは主に密接な接触や体液の交換を通じて発生します。
トリコモナス症は性行為を通じて感染する代表的な原虫感染症で泌尿生殖器系に影響を与えます。
また一部の原虫感染症では母子感染のリスクもあり妊娠中や出産時に胎児に感染する恐れもあります。
| 感染経路 | 代表的な原虫感染症 |
| 性行為 | トリコモナス症 |
| 母子感染 | トキソプラズマ症 |
| 糞口感染 | ランブル鞭毛虫症 |
人から人への直接感染は衛生習慣や性行動 妊婦のケアなど個人の生活習慣や医療環境と密接に関連しています。
環境因子と宿主の状態
原虫感染症の発生には環境因子と宿主の状態が大きく関わっています。
これらの要因は感染のリスクを高めたり感染後の経過に影響を与えたりする可能性があります。
以下は原虫感染症の環境因子です。
- 気候条件(温度 湿度)
- 衛生状態
- 都市化や人口密度
- 動物との接触機会
一方で宿主側の要因としては次のようなものが重要です。
- 免疫状態
- 年齢
- 栄養状態
- 既往歴
| 環境因子 | 影響を受けやすい原虫感染症 |
| 高温多湿 | マラリア・リーシュマニア症 |
| 衛生状態不良 | アメーバ赤痢・クリプトスポリジウム症 |
これらの因子は複雑に絡み合い、原虫感染症の流行パターンや個人のリスクに影響を与えます。
例えば 免疫不全状態にある人は通常では問題にならない原虫にも感染しやすく重症化するリスクが高くなります。
また気候変動による環境の変化は媒介生物の生息域を拡大させて新たな地域での原虫感染症の流行を引き起こすリスクが生じるのです。
2020年にNature Communicationsに掲載された研究によると気候変動に伴う気温上昇が マラリア媒介蚊の生息域を拡大させます。
そして従来はマラリアの流行がなかった高地域でも感染リスクが高まっていることが報告されています。
この研究結果は環境因子の変化が原虫感染症の分布に大きな影響を与える可能性を示唆しており感染症対策における環境モニタリングの重要性を浮き彫りにしています。

診察と診断
原虫感染症の診断は単一の検査方法だけでなく複数のアプローチを組み合わせることでより正確な結果が得られます。
患者さんの状態や疑われる原虫の種類に応じて適切な検査方法を選択して総合的に判断を行います。
本項では原虫感染症の診察過程と主な診断方法について詳しく解説します。
問診と身体診察
原虫感染症の診断において問診は極めて重要な役割を果たします。
医師は患者さんの旅行歴・食事習慣・生活環境などについて詳しく質問して感染の可能性がある原虫を推測します。
例えば熱帯地域への渡航歴がある患者さんの場合マラリアなどの特定の原虫感染症のリスクが高くなる傾向です。
また、身体診察では医師が患者さんの全身状態を確認して特徴的な徴候を探ります。
これには体温測定・腹部の触診・皮膚の観察などが含まれます。
| 問診項目 | 関連する可能性のある原虫感染症 |
| 熱帯地域への渡航歴 | マラリア・リーシュマニア症 |
| 生水や生野菜の摂取 | ジアルジア症・アメーバ赤痢 |
| ペットとの接触 | トキソプラズマ症 |
問診と身体診察の結果は後続の検査方法の選択や診断の方向性を決定する上で大切な情報となります。
顕微鏡検査
顕微鏡検査は原虫感染症の診断において基本的かつ重要な手法です。
患者さんの血液・便・尿・その他の体液や組織サンプルを顕微鏡で観察し原虫の存在を直接確認します。
例えばマラリアの診断では血液塗抹標本を用いて赤血球内のマラリア原虫を観察します。
顕微鏡検査の利点は迅速な結果が得られること、原虫の種類や発育段階を直接確認できることです。
一方でこの方法は検査者の経験と技術に依存するため熟練した技師による判断が不可欠です。
| 検体の種類 | 主な対象原虫感染症 |
| 血液 | マラリア・バベシア症 |
| 便 | アメーバ赤痢・ランブル鞭毛虫症 |
| 尿 | トリコモナス症 |
血清学的検査
血清学的検査は患者さんの血液中に存在する原虫に対する抗体や抗原を検出する方法で原虫に感染したことがあるかどうかを判断するのに役立ちます。
主な血清学的検査方法は次のようなものです。
- ELISA法(酵素免疫測定法)
- 間接蛍光抗体法
- ウエスタンブロット法
これらの方法は特定の原虫に対する抗体の有無や量を測定して感染の有無や経過を推測します。
例えばトキソプラズマ症の診断ではIgM抗体とIgG抗体の両方を測定して感染の時期や状態を判断します。
血清学的検査の利点は大量の検体を同時に処理できること、過去の感染歴も含めて判断できることです。
一方で 抗体の産生には時間がかかるため急性期の診断には不向きな場合があります。
分子生物学的検査
分子生物学的検査は原虫の遺伝子を直接検出する方法で高い精度と感度を持つことが特徴です。
代表的な方法としてPCR法(ポリメラーゼ連鎖反応)があります。
PCR法は原虫の特定の遺伝子配列を増幅して検出するため極めて少量の原虫でも検出可能です。
この方法は特に従来の方法では検出が難しかった原虫感染症の診断に威力を発揮します。
例えばバベシア症の診断ではPCR法が高い感度と特異度を示すことが知られています。
| 検査方法 | 特徴 | 主な対象原虫感染症 |
| PCR法 | 高感度・高特異度 | バベシア症・トキソプラズマ症 |
| LAMP法 | 簡便・迅速 | マラリア・リーシュマニア症 |
分子生物学的検査は原虫の種類の同定や薬剤耐性の検出にも応用されており、診断精度の向上に大きく貢献しています。

原虫感染症の画像所見
原虫感染症の画像診断は感染の進行度や合併症の評価に重要な役割を果たします。
本稿では代表的な原虫感染症の画像所見について臓器別に詳しく解説します。
脳の画像所見
脳に影響を及ぼす原虫感染症ではMRIやCTが診断に有用です。
脳マラリアの場合MRIで大脳白質や脳梁に多発性の高信号域が観察されることがあります。
これらの所見は脳浮腫や微小出血を反映しているとされています。
トキソプラズマ脳症では造影CTやMRIでリング状に造影される多発性の病変が特徴的です。
これらの病変は主に大脳基底核や皮質下白質に見られ ときに標的徴候(target sign)と呼ばれる同心円状の構造を示します。
| 感染症 | 主な画像所見 |
| 脳マラリア | MRIでの白質高信号 |
| トキソプラズマ脳症 | リング状造影病変 |
脳の画像所見は原虫感染症の重症度評価や治療効果の判定に重要な情報を提供します。
![Comparative MRI findings between case 1 and a patient from an Indian cerebral malaria series [1]. The acute stage of the disease is seen in day 1 images from Rourkela, India. The early subacute stage is seen in day 7 images from London and day 4 images from Roukela, and residual changes are seen in day 50 images from London. A, Representative T2-weighted images, ADC maps, and susceptibility-weighted images (SWI) of case 1 are displayed at the level of the basal ganglia. Day 7 (GCS 4): The T2-weighted image shows a right T2 hyperintense striatocapsular infarct (arrow, first row). In addition, there is more ill-defined T2 hyperintense signal in the subcortical white matter bilaterally (arrowhead) and corona radiata representing vasogenic edema with corresponding increase in ADC. There is sulcal effacement posteriorly (and to a lesser degree, anteriorly) indicating brain swelling. In addition to the striatocapsular infarct, there is symmetrical ADC decrease in the putamen bilaterally (arrows, second row) and in the corpus callosum, consistent with mild cytotoxic edema. The SWI shows subtle areas of punctate susceptibility artefacts in the internal capsules and subcortical white matter. Day 15 (GCS 7): T2 hyperintensities in the right striatum and posterior internal capsule and corona radiata remain, while sulci are now clearly visible, indicating brain swelling reversal. There is no longer evidence of cytotoxic edema with reduced ADC. The areas of increased T2 signal show increased ADC corresponding to residual vasogenic edema in the subcortical white matter and corona radiata. Numerous areas of susceptibility artefacts are now much more clearly visible in the subcortical white matter (arrowhead points at susceptibility artefacts in the occipital subcortical white matter), corpus callosum, corona radiata and internal capsules, corresponding to microthrombi or microhemorrhages. Day 50 (GCS 15): A well-defined T2 hyperintensity indicates maturation of the right capsular infarct (arrow). The ADC signal has normalised. Extensive areas of susceptibility artefact persist within the same distribution as at day 15, appearing more prominent as imaging has been performed at 3 T compared to 1.5 T previously (arrowhead points at susceptibility artefacts in the occipital subcortical white matter). Thus, at day 50 brain swelling has completely reversed, with a mature right striatocapsular infarct and microthrombi/microhemorrhages in the subcortical white matter, corpus callosum, corona radiata and internal capsules. B, ADC maps at the level of the superior corona radiata/centrum semiovale of case 1 show an ADC decrease at day 7 (arrows), a mildly increased ADC on day 15 (arrow) and a fully normalised ADC at day 50. C, representative T2-weighted images, ADC maps and SWI of a 32-year-old Indian male with CM are displayed at the level of the basal ganglia. Day 1 (GSC 5): An increased T2 signal is evident in the cortex and the slightly swollen lateral basal ganglia (putamen, arrows). Sulci are narrowed. ADC decrease is seen in the subcortical white matter (arrowhead) and basal ganglia (putamen, arrows), as in 1A. On SWI no clear pathological signal is apparent. Brain swelling is evident with mild cytotoxic edema in the subcortical white matter and basal ganglia. Day 4 (GCS 15): The T2 signal in the basal ganglia (arrows) and the cortex has normalised. Residual ADC decrease is seen in the occipital white matter (arrowhead). On the SWI image multiple susceptibility artefacts are seen in the subcortical white matter, corpus callosum and basal ganglia. Thus, brain swelling has reversed with remaining slight cytotoxic edema in the occipital white matter and newly apparent microthrombi/microhemorrhages in the subcortical white matter (arrowhead), corpus callosum and basal ganglia. Microthrombi/microhemorrhages have the same distribution as in 1A. D, ADC map of a 22-year-old Indian male with CM at the level of the corona radiata. Day 1 (GCS 5): Cytotoxic edema, evidenced as ADC decrease is evident in the subcortical white matter (arrowhead) with sparing of the corona radiata. Day 4 (GCS 15): Cytotoxic edema, evidenced as ADC decrease is now apparent in the corona radiata (arrows), whereas most of the previously affected subcortical white matter does not show an ADC decrease anymore, similar to the appearance in 1B. Diffusion restriction was also present in the basal ganglia on day 1, resolved by day 4 (not shown). Abbreviations: ADC, apparent diffusion coefficient; CM, cerebral malaria; GCS, Glasgow coma scale; MRI, magnetic resonance imaging; SWI, susceptibility weighted imaging.](https://oup.silverchair-cdn.com/oup/backfile/Content_public/Journal/cid/78/2/10.1093_cid_ciad651/1/m_ciad651f1.jpeg?Expires=1732493198&Signature=tieu0x8epif7E6VI7Ok51WigPhC1Hs9QnXOTzx3VCM2bSvOxclOHiyrYx6Eb0uJrJ97AChxii~SV3kMQSwK8eSWFd-HR61KncEopq40jtVQjvbeG8Bt8s~SX3~UNEHL5HRG9h1UapzHY3wId3HZRH3U7zLW16oeDr7yDvA-nPwDS7~r8bxfb0XcpQBS1xZvFkEHtaDpQK9F7l~azi1zEAMhXZIrxKBbY~8NbbDfx2DHwMrN5iBibt4q73Ghbe0F4mevmeuVog6M8pco-KmygzogP9DRl1BvWYLCnO0Jn0VX~Nk7VMd0QsvTkkpb6bHL8b2xE7IfLcVHo5LNLf8pFWw__&Key-Pair-Id=APKAIE5G5CRDK6RD3PGA)
所見:「ケース1とインドの脳マラリア症例のMRI比較所見。インドのルーケラでの急性期画像は1日目のものであり、ロンドンでの早期亜急性期は7日目、ルーケラでの亜急性期は4日目の画像、また50日目のロンドンでの画像は残存変化を示している。(A) 基底核レベルでの代表的なT2強調画像、ADCマップ、およびSWI画像がケース1で表示されている。7日目(GCS 4):T2強調画像には右の線状被殻梗塞(矢印、最上段)が示され、両側の皮質下白質および放線冠には不明瞭なT2高信号が見られ、血管性浮腫を示しADCが増加している。また、後方(および若干前方)の脳回が消失しており、脳の腫脹が示唆される。内包後肢には軽度のADC減少が見られ、細胞毒性浮腫を示している。SWIでは内包および皮質下白質に小さな感受性アーチファクトが確認される。15日目(GCS 7):右線状被殻と後内包、放線冠のT2高信号は残っているが、脳回が明確に見られ、腫脹の回復が示される。T2信号増加領域には残存血管性浮腫が見られ、皮質下白質および放線冠に対応してADCが増加。アーチファクトは、皮質下白質や脳梁、放線冠、内包に確認され、微小血栓または微小出血を示唆する。50日目(GCS 15):明確なT2高信号は右線状被殻梗塞の成熟を示し、ADC信号は正常化。アーチファクトの分布は15日目と同じで、3Tでの撮像により1.5Tより顕著に表示されている。脳腫脹は完全に回復し、右線状被殻梗塞と皮質下白質、脳梁、放線冠、内包の微小血栓/微小出血が残存。
(B) 放線冠/半卵中心でのADCマップは、7日目にADC減少、15日目に軽度の増加、50日目に完全な正常化を示す。
(C) 32歳男性患者(脳マラリア)の基底核レベルでのT2強調画像、ADCマップ、およびSWI画像。1日目(GCS 5):基底核(被殻)と皮質でT2信号増加が確認され、脳回は狭小。皮質下白質と基底核にADC減少。SWIでの明らかな病理信号はなく、脳腫脹と軽度の細胞毒性浮腫が確認される。4日目(GCS 15):基底核と皮質のT2信号が正常化し、後頭部白質に残存するADC減少。SWIで皮質下白質、脳梁、基底核に多数のアーチファクトが見られる。脳腫脹は回復し、後頭部白質には微小血栓/微小出血が確認。
(D) 放線冠レベルでの22歳男性患者(脳マラリア)のADCマップ。1日目(GCS 5):皮質下白質に細胞毒性浮腫(ADC減少)が確認され、放線冠は影響を受けない。4日目(GCS 15):放線冠にADC減少が現れ、以前影響を受けていた皮質下白質ではADC減少が解消。基底核の拡散制限も1日目に確認され、4日目には回復。」
肝臓の画像所見
肝臓に影響を与える原虫感染症では超音波検査やCTが診断に役立ちます。
アメーバ性肝膿瘍(かんのうよう)の場合は超音波検査で辺縁不整な低エコー域として観察されます。
CTでは造影効果の乏しい低吸収域として描出され周囲に浮腫性変化を伴うことがあります。
マラリアによる肝腫大では超音波検査で肝臓全体の腫大と実質エコーの不均一化が見られることがあります。
| 感染症 | 超音波所見 | CT所見 |
| アメーバ性肝膿瘍 | 低エコー域 | 低吸収域 |
| マラリア性肝腫大 | びまん性腫大 | 軽度腫大 |
肝臓の画像所見は病変の範囲や数を評価する上で重要であり治療方針の決定に影響を与えることがあります。
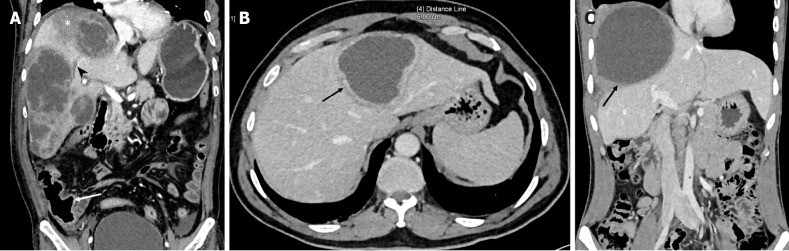
所見:「CT(冠状断画像)で、敗血症様の症状と著しく乱れた検査結果を呈した60歳男性における急性攻撃的膿瘍(タイプIパターン)の特徴的な画像所見を示す。右葉に不規則でギザギザの縁を持つ複数の膿瘍があり、複数の中隔と異なる密度が見られ、部分的な組織の液化を示唆している。また、周囲の実質内に低密度領域(アスタリスク)と右肝静脈血栓(矢じり)が確認される。肥厚した盲腸壁(矢印)および軽度の腹水も明らかである。
B: 軽度の症状を呈する亜急性の典型的なケースのCT画像。検査プロファイルはほぼ正常。軸位画像では左葉に壁が明確で縁状造影を示す膿瘍が確認され(タイプIIパターン)、この患者は症状発現から20日後に軽度の腹痛を訴えていた。
C: 慢性緩徐性膿瘍(タイプIIIパターン)のCT画像。24歳男性の冠状断画像で、右葉に厚い非造影性の壁を持つ大きな膿瘍が確認される。患者はメトロニダゾール治療後に発熱が完全に解消し、検査結果も正常化したが、2ヶ月間右上腹部の痛みが持続していた。」
腸管の画像所見
腸管に影響を及ぼす原虫感染症では内視鏡検査やCTが診断に有用です。
アメーバ性大腸炎の場合はCT検査で腸管壁の肥厚や周囲の脂肪織濃度上昇が観察されることがあります。
さらに内視鏡検査では特徴的なフラスコ状潰瘍が認められることがあります。
クリプトスポリジウム症では小腸造影検査で小腸壁の肥厚や粘膜ひだの不整が見られることがあります。
これらの所見は非特異的な場合も多いため臨床症状や他の検査結果と併せて総合的に判断することが大切です。
| 感染症 | 内視鏡所見 | CT所見 |
| アメーバ性大腸炎 | フラスコ状潰瘍 | 腸管壁肥厚 |
| クリプトスポリジウム症 | 粘膜浮腫 | 小腸壁肥厚 |
腸管の画像所見は感染の範囲や重症度を評価する上で重要な情報を提供します。
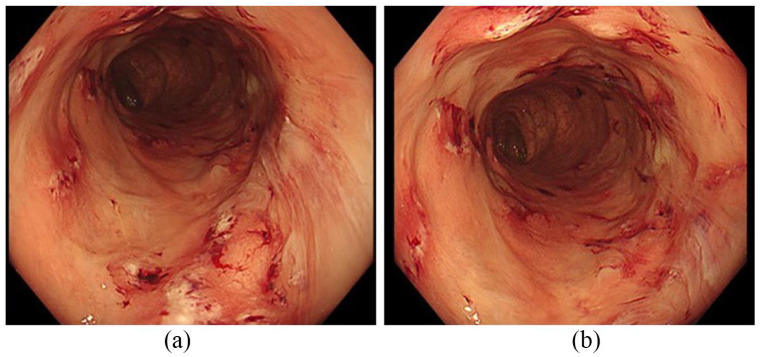
所見:「アメーバ性大腸炎の症例。(a) および (b) 直腸に3~5 mmの潰瘍が複数確認され、四分円状に配置されており、出血の兆候が見られる。」
肺の画像所見
肺に影響を与える原虫感染症では胸部X線検査やCTが診断に用いられます。
トキソプラズマ肺炎の場合は胸部CTで両側性のすりガラス影や小葉中心性の結節影が観察されることがあります。
これらの所見は非特異的であり他の感染症や疾患との鑑別が不可欠です。
マラリアの重症例では急性呼吸窮迫症候群(ARDS)を合併して胸部X線で両側性のびまん性浸潤影が見られることがあります。
肺の画像所見は原虫感染症の合併症を評価する上で重要な役割を果たします。
肺の画像所見で観察される主な変化は以下の通りです。
- びまん性すりガラス影
- 小葉中心性結節影
- 両側性浸潤影
- 胸水貯留
これらの所見は原虫感染症の種類や重症度によって様々な組み合わせで出現します。

所見:「トキソプラズマ肺炎の症例。胸部CTスキャンで両側下葉優位のすりガラス様陰影および両側下葉の無気肺が確認された。鑑別診断にはPJP(ニューモシスチス肺炎)、非定型肺炎、ウイルス感染症などが挙げられる。
全身の画像所見
一部の原虫感染症では全身に影響を及ぼすことがあり、複数の臓器に画像所見が認められることがあります。
例えばマラリアの重症例では次のような全身性の画像所見が観察されることがあります。
- 脾腫(超音波検査やCTで評価)
- 肺水腫(胸部X線やCTで評価)
- 脳浮腫(頭部CTやMRIで評価)
- 腎臓の腫大(腹部超音波検査やCTで評価)
これらの全身性の画像所見は 原虫感染症の重症度や合併症の評価に重要な情報を提供します。
| 臓器 | 代表的な画像所見 |
| 脾臓 | 腫大・内部エコー不均一 |
| 肺 | びまん性浸潤影・胸水 |
| 脳 | 浮腫・微小出血 |
| 腎臓 | 腫大・エコー輝度上昇 |
全身の画像所見を総合的に評価することで原虫感染症の全身状態や治療効果を的確に判断することが可能です。
2022年にThe Lancetに掲載された研究ではAI技術を用いた画像解析が原虫感染症の早期診断や重症度評価に有用である可能性が報告されています。
この研究結果は画像診断技術の進歩が原虫感染症の管理に新たな展開をもたらす可能性を示唆しています。

治療方法と薬
原虫感染症の治療は原虫の種類や感染の重症度によって異なりますが適切な薬物療法と支持療法の組み合わせが基本です。
適切な治療法の選択と患者さんの全身管理を組み合わせることで多くの原虫感染症は治癒に至ることが可能です。
本項では代表的な原虫感染症の治療方法・使用される薬剤・治癒までの期間について詳しく解説します。
抗原虫薬による治療
原虫感染症の主な治療法は抗原虫薬を用いた薬物療法です。
抗原虫薬は原虫の種類や感染部位によって選択され、単剤または複数の薬剤を組み合わせて使用されます。
例えばマラリアの治療ではアルテミシニン誘導体とその他の抗マラリア薬を組み合わせたアルテミシニン併用療法(ACT)が広く用いられています。
この治療法は世界保健機関(WHO)によって推奨されており、耐性の出現を抑制しつつ高い治療効果が得られるのです。
| 原虫感染症 | 主な治療薬 |
| マラリア | アルテミシニン併用療法 |
| アメーバ赤痢 | メトロニダゾール |
| ジアルジア症 | メトロニダゾール・チニダゾール |
抗原虫薬の選択は原虫の薬剤感受性や患者さんの状態を考慮して行われます。
支持療法
原虫感染症の治療では抗原虫薬による直接的な治療に加えて支持療法が重要な役割を果たします。
支持療法は患者さんの全身状態を改善して治療の効果を高めるとともに合併症のリスクを軽減することが目的です。
主な支持療法は次の通りです。
- 輸液療法(脱水の改善)
- 解熱鎮痛薬(発熱や痛みの緩和)
- 制吐薬(嘔吐の抑制)
- 栄養サポート(栄養状態の改善)
これらの支持療法は患者さんの症状や全身状態に応じて適切に選択されます。
特に重症例や合併症を伴う場合には集中治療が必要となることもあります。
治療期間と経過観察
原虫感染症の治療期間は 原虫の種類や感染の重症度 患者さんの免疫状態などによって異なります。
軽症から中等症の原虫感染症では数日から数週間の治療期間が一般的です。
例えば通常のマラリア治療期間は3日間程度ですが、アメーバ赤痢の場合は7〜10日間の治療が必要となることがあります。
| 原虫感染症 | 一般的な治療期間 |
| マラリア | 3〜7日 |
| アメーバ赤痢 | 7〜10日 |
| トキソプラズマ症 | 2〜6週間 |
治療後は定期的な経過観察が行われ、再発や合併症の有無が確認されます。
完全な治癒の判定には臨床症状の消失だけでなく検査結果の正常化も重要な指標です。
薬剤耐性への対応
近年 一部の原虫感染症において薬剤耐性が問題となっています。
特にマラリアでは従来の抗マラリア薬に対する耐性が世界的に報告されており治療の難しさが増しています。
薬剤耐性への対策として次のような取り組みが行われています。
- 複数の薬剤を組み合わせた併用療法
- 新規抗原虫薬の開発
- 薬剤感受性試験の実施
- 地域ごとの耐性パターンのモニタリング
これらの対策により薬剤耐性原虫による感染症に対しても効果的な治療法の選択が可能となっています。
免疫不全患者の治療
HIV感染症や臓器移植後など免疫機能が低下している患者さんでは原虫感染症の治療がより複雑になることがあります。
これらの患者さんでは通常よりも長期間の治療や高用量の薬剤投与が必要となる場合があるのです。
また再発のリスクが高いため長期的な予防投与が行われることもあります。
| 免疫状態 | 治療の特徴 |
| 正常 | 標準的な治療期間・用量 |
| 軽度低下 | やや長めの治療期間 |
| 重度低下 | 長期治療・高用量投与 |
免疫不全患者さんの原虫感染症治療では原疾患の管理と並行して慎重な経過観察が大切です。
2023年にNew England Journal of Medicineに掲載された研究では新しい抗マラリア薬の開発により従来の薬剤耐性マラリアに対しても高い治療効果が報告されています。
この研究結果は薬剤耐性原虫に対する新たな治療戦略の可能性を示唆しており、今後の原虫感染症治療の発展が期待されます。

原虫感染症治療の副作用とリスク
原虫感染症の治療に用いられる薬剤は多くの場合効果的ですが、同時に様々な副作用やリスクを伴う可能性があります。
それらは決して無視できるものではありませんが適切な管理と対応によって 多くの場合で軽減または回避することが可能です。
本稿では原虫感染症治療に関連する主な副作用やデメリットについて 詳しく解説します。
消化器系の副作用
原虫感染症の治療に用いられる多くの薬剤は消化器系に影響を与えることがあります。
特にメトロニダゾールやチニダゾールといった薬剤では嘔気・嘔吐・腹痛・下痢などの症状が比較的高頻度で報告されています。
これらの副作用は薬剤の服用中や服用直後に現れることが多く患者さんの日常生活に支障をきたす恐れも生じます。
| 薬剤名 | 主な消化器系副作用 |
| メトロニダゾール | 嘔気・嘔吐・腹部不快感 |
| チニダゾール | 悪心・食欲不振 |
| クロロキン | 腹痛・下痢 |
消化器系の副作用は多くの場合一時的なものですが重度の場合は治療の中断や変更が必要となることもあります。
皮膚反応
一部の抗原虫薬では皮膚に関連する副作用が報告されていて、これには軽度の発疹から重篤なアレルギー反応まで 幅広い症状が含まれます。
例えばクロロキンやヒドロキシクロロキンでは光線過敏症が起こることがあり、日光に当たった部分に発疹や痒みが生じる可能性があります。
またメフロキンでは重度の皮膚反応(スティーブンス・ジョンソン症候群など)が稀に報告されていて注意が必要です。
以下は皮膚反応のリスクがある主な薬剤とその副作用です。
- クロロキン ・ヒドロキシクロロキン(光線過敏症・色素沈着)
- メフロキン(重度の皮膚反応)
- スルファドキシン・ピリメタミン(発疹・蕁麻疹)
これらの副作用が現れた場合には速やかに医療機関に相談することが大切です。
神経系への影響
一部の抗原虫薬は中枢神経系に影響を与えて様々な神経学的副作用を引き起こす可能性があります。
特にメフロキンは精神神経系の副作用が比較的高頻度で報告されており不安・抑うつ・睡眠障害・悪夢などの症状が現れることがあります。
またクロロキンやヒドロキシクロロキンの長期使用では稀に網膜症のリスクが増加するとされています。
| 薬剤名 | 主な神経系副作用 |
| メフロキン | 不安・抑うつ・睡眠障害 |
| クロロキン | めまい・頭痛・網膜症(長期使用時) |
| エフロルニチン | 痙攣・めまい |
神経系の副作用は 患者さんの生活の質に大きな影響を与える可能性があるため慎重なモニタリングが必要です。
血液学的副作用
一部の抗原虫薬では血液細胞に影響を与えて様々な血液学的副作用を引き起こす可能性があります。
例えばピリメタミンを含む薬剤では葉酸代謝阻害作用により貧血や白血球減少、血小板減少などが起こることがあります。
またアトバコンでは稀に好中球減少が報告されています。
これらの副作用は通常の血液検査で発見されることが多く定期的な検査が重要です。
以下は血液学的副作用のリスクがある主な薬剤とその影響です。
- ピリメタミン(貧血・白血球減少・血小板減少)
- アトバコン(好中球減少)
- ペンタミジン(血小板減少・白血球減少)
血液学的副作用が疑われる場合は医師の判断により投薬の中止や用量調整が行われることがあります。
薬物相互作用のリスク
原虫感染症の治療に用いられる薬剤の中には他の薬剤と相互作用を起こす可能性があるものがあります。
これらの相互作用は薬剤の効果を減弱させたり副作用のリスクを増大させたりする可能性が生じます。
例えばメトロニダゾールはアルコールと併用すると悪心や嘔吐、頭痛などの不快な症状(ジスルフィラム様反応)を引き起こすことがあります。
またクロロキンは多くの薬剤と相互作用を示してQT延長のリスクを高める可能性があります。
| 抗原虫薬 | 相互作用のある主な薬剤 |
| メトロニダゾール | アルコール・ワルファリン |
| クロロキン | QT延長を起こす薬剤・制酸剤 |
| アトバコン | リファンピシン・メトクロプラミド |
薬物相互作用のリスクを最小限に抑えるためには服用中の全ての薬剤(処方薬・市販薬・サプリメントなど)について医師や薬剤師に相談することが大切です。

原虫感染症の治療費 個人負担の実態
原虫感染症の治療費は使用する薬剤や治療期間によって大きく変動します。
本項では処方薬の薬価や治療期間別の費用について解説します。
処方薬の薬価
原虫感染症治療に用いる薬剤の価格は種類や製薬会社によって異なります。
例えばマラリア治療薬のアルテメテル/ルメファントリン配合錠は1錠あたり246.8円です。
一方アメーバ赤痢に使用するメトロニダゾールは1錠36.2円と比較的安価です。
1週間の治療費
1週間の治療費は薬剤の種類と用量、通院回数などにより変化します。
マラリアの場合は3日間の治療で薬剤費が5,923.2円、外来診療費を含めると1〜2万円程度になることがあります。
アメーバ赤痢では、7日間の治療で薬剤費が760.2円、外来診療費を含め5000円~1万円程度です。
1か月の治療費
長期治療が必要な原虫感染症の場合、1か月の治療費はさらに高額になります。
トキソプラズマ症などでは4〜6週間の治療が必要で薬剤費と診療費を合わせると3万円以上かかる場合もあります。
入院治療が必要な重症例ではさらに費用が増加します。
なお、上記の価格は2024年10月時点のものであり、最新の価格については随時ご確認ください。
以上

- 参考にした論文


