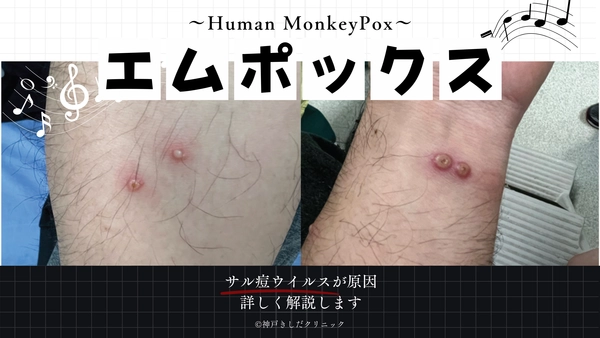
感染症の一種であるエムポックスとはサル痘ウイルスが原因となって発症する感染症です。
この病気はかつてアフリカの特定地域でのみ確認されていました。
世界中で感染例が増加している現在、その症状は発熱や強い倦怠感から始まります。
その後は体の表面に特徴的な発疹や水疱が出現することが分かっています。
感染経路として最も多いのは感染者との直接的な接触です。
また、感染者が使用したタオルや寝具などを介した間接的な接触でも感染する可能性があります。
そのため早期に医療機関を受診して適切な予防措置を取ることが求められています。

神戸きしだクリニック公式Youtubeチャンネルでの音声解説はこちら。
エムポックスの病型分類と地域特性
サル痘ウイルスの遺伝子解析によりエムポックスには主にコンゴ盆地型(クレードⅠ)と西アフリカ型(クレードⅡ)の2つの病型が存在します。
この2つの病型はそれぞれ特徴的な地理的分布と遺伝的特性を持ち、世界保健機関(WHO)による詳細な調査研究の対象となっています。
病型分類の歴史的背景
エムポックスの病型分類は1970年代から継続的な研究によって確立されました。
当初は臨床所見による分類が中心でしたが、分子生物学的手法の発展によって遺伝子配列の違いに基づく正確な分類が可能となりました。
この分類方法の確立によって地域特性と密接に関連した2つの主要な系統が特定され、それぞれの型における特徴的な遺伝子マーカーも同定されることとなりました。
| 分類時期 | 主な研究地域 |
|---|---|
| 1970年代 | 中央アフリカ |
| 2000年代 | 西アフリカ |
研究の進展に伴い各病型の地理的分布パターンが明確になり、それぞれの型における遺伝的変異の蓄積過程についても理解が深まってきました。
コンゴ盆地型(クレードⅠ)の特徴
コンゴ盆地型は主にコンゴ民主共和国を中心とする中央アフリカ地域で確認されている系統です。
この型のウイルスは遺伝的な多様性が比較的高いことが重要な特徴となっています。
遺伝子解析の結果からコンゴ盆地型は長期にわたって当該地域に定着していたことが示唆され、地域の生態系との相互作用の中で独自の進化を遂げてきたと考えられています。
- コンゴ民主共和国での優勢株
- 中央アフリカ共和国での検出例
- カメルーンでの発生報告
この型の地理的分布は熱帯雨林地帯の生態系と密接に関連しており、特に野生げっ歯類との関係性が注目されています。
西アフリカ型(クレードⅡ)の分布
西アフリカ型はナイジェリアやシエラレオネなどの西アフリカ諸国で主に確認されている系統です。
この型はサバンナ気候帯を中心に分布しており、独自の生態学的ニッチを形成しています。
2022年以降の世界的な流行の大部分がこの型によるもので国際的な公衆衛生上の関心が高まっています。
| 地域 | 確認された年 |
|---|---|
| ナイジェリア | 1971年 |
| シエラレオネ | 1970年 |
西アフリカ型の特徴として遺伝的な安定性が挙げられます。
この特性はウイルスの進化速度や適応戦略を理解する上で重要な手がかりとなっています。
遺伝子学的特性
両型の遺伝子配列には明確な違いが存在してこれらの違いは進化の過程で形成されたと考えられています。
遺伝子解析技術の発展により両型の詳細な遺伝的特徴が明らかになってきました。
分子系統学的研究により、中央アフリカ系統(Clade I)と西アフリカ系統(Clade II)が分岐したのは、およそ500~800年前と推定されています。
この長期にわたる分断が現在観察される遺伝的な違いを生み出したと考えられています。
- 遺伝子配列の相違点
- 進化的分岐の時期
- 地理的隔離の影響
| 特性 | コンゴ盆地型 | 西アフリカ型 |
|---|---|---|
| 遺伝子多様性 | 高い | 比較的低い |
| 主な分布地域 | 中央アフリカ | 西アフリカ |
| 確認年 | 1970年 | 1971年 |
地域特異的な分布パターン
各病型の地理的分布には明確な境界が存在し、この分布パターンは自然宿主の生息域や人口移動のパターンと関連している可能性があります。
地理的な隔離はそれぞれの型が独自の進化経路を辿る要因となっており、この過程で異なる遺伝的特徴が確立されてきました。
現代のグローバル化に伴い従来の地理的境界を越えた伝播が観察されるようになってきており、このことは公衆衛生学的な観点から注目されています。

エムポックスの主症状
エムポックスの症状は潜伏期間を経て発症する感染症です。
初期症状として発熱や倦怠感が現れ、その後に特徴的な発疹が出現します。
症状の進行は病型によって異なり、コンゴ盆地型(クレードⅠ)と西アフリカ型(クレードⅡ)で若干の違いが見られます。
潜伏期間と初期症状
潜伏期間は通常5日から21日でこの期間中は無症状です。
初期症状として38度以上の発熱、強い倦怠感、頭痛、筋肉痛などのインフルエンザに似た症状が現れることが重要な特徴です。
リンパ節の腫れは他のウイルス感染症との鑑別において特に注目すべき症状となっています。
| 初期症状 | 出現頻度 |
|---|---|
| 発熱 | 非常に多い |
| リンパ節腫脹 | 多い |
| 頭痛 | 多い |
| 筋肉痛 | 比較的多い |
発疹の特徴と進行過程
発疹は初期症状の1-3日後に顔面から始まり、次第に体幹、四肢へと広がっていく傾向です。
発疹は次のような段階を経て進行していきます。
- 斑点(まだらな赤み)から丘疹(盛り上がった発疹)
- 水疱(水泡)から膿疱(膿を含んだ水泡)
- かさぶた形成から治癒
発疹は約2-4週間続き、この間の発疹状態は同じ部位でほぼ同じ段階にあることが特徴的です。
病型による症状の違い
コンゴ盆地型(Clade I)と西アフリカ型(Clade II)では皮膚病変の見た目に体系的な差は確認されていません。どちらの型でも発疹は類似の経過を辿り、中心に臍窩を持つ膿疱を形成します 。
違いがあるとすれば、Clade Iの方が症例によっては発疹数が多く重症化しやすい傾向がある程度です。
| 症状の特徴 | コンゴ盆地型 | 西アフリカ型 |
|---|---|---|
| 発熱の程度 | より高い | 比較的穏やか |
| 発疹の数 | より多い | 比較的少ない |
| リンパ節腫脹 | 顕著 | 軽度 |
両型とも発疹の性状自体は類似していますが、その数や分布には違いが認められます。
粘膜症状について
口腔内、生殖器、眼などの粘膜症状も起こることがあり、これは患者さんの生活の質に大きな影響を与える要因です。
- 口腔内の痛みや違和感
- 目の充血や痛み
- 生殖器の不快感
全身症状の経過
全身症状は発症から回復まで段階的に変化していきます。
| 時期 | 主な症状 |
|---|---|
| 発症初期 | 発熱・倦怠感 |
| 中期 | 発疹・リンパ節腫脹 |
| 後期 | かさぶた形成 |

Mpoxの感染原因と発生メカニズム
エムポックスはオルソポックスウイルス属に属するサル痘ウイルスによって引き起こされる感染症で、その感染経路や発生メカニズムは複雑な生態学的相互作用を含んでいます。
主にアフリカの野生動物が自然宿主でヒトへの感染は直接的な接触や飛沫を介して発生することが知られています。
ウイルスの特性と感染経路
サル痘ウイルスは二本鎖DNAウイルスとして分類されてその遺伝子構造は他のポックスウイルスと類似した特徴を持っています。
このウイルスの特筆すべき点は環境中での安定性が比較的高いことです。
ウイルスの物理的特性として脂質二重膜を持つエンベロープウイルスであることが挙げられ、この構造が感染性や環境抵抗性に深く関与しています。
| ウイルスの性質 | 特徴 |
|---|---|
| 遺伝子構造 | 二本鎖DNA |
| 環境安定性 | 比較的高い |
| 感染力 | 中程度 |
| 耐熱性 | 低~中程度 |
感染経路の多様性は、公衆衛生上の重要な課題となっています。
直接接触による感染が主要な経路ですが、飛沫感染や環境を介した間接的な感染も報告されています。
自然宿主と感染サイクル
アフリカの熱帯雨林地域には多様な野生動物が生息しており、これらの動物がウイルスの自然宿主として機能しています。
特にげっ歯類は主要な保有宿主として注目されていて生態系内でのウイルス循環に重要な役割を果たしています。
野生動物間でのウイルス伝播は複雑な生態系のネットワークを通じて維持され、季節性や気候変動の影響を受けることが研究により明らかになってきています。
- リスやネズミなどの小型げっ歯類
- サルなどの霊長類
- アフリカオオヤマアラシ
これらの動物種はそれぞれ異なる生態学的ニッチを占めておりウイルスの維持と伝播に独自の役割を果たしています。
| 宿主動物 | 主な生息地 |
|---|---|
| アフリカリス | 熱帯雨林 |
| ガンビアネズミ | サバンナ |
| サル類 | 森林地帯 |
地域特異的な感染要因
コンゴ盆地型(クレードⅠ)と西アフリカ型(クレードⅡ)の地理的分布はそれぞれの地域における生態系の特徴と密接に関連しています。
コンゴ盆地型は熱帯雨林の生態系に適応して高湿度環境下での感染伝播が特徴的です。
一方で西アフリカ型は、よりサバンナ的な環境に適応して異なる感染動態を示しています。
地域による感染パターンの違いは次のような要因と密接に関連しています。
- 生態系の違いによる宿主動物の分布
- 人間の生活様式と野生動物との接触パターン
- 気候条件による環境要因の変化
感染リスクを高める環境要因
現代社会における環境変化はウイルスと人間の接触機会を増加させる重要な要因です。
森林開発や都市化の進展は野生動物の生息地を縮小させて人間との接触機会を増加させています。
気候変動による生態系の変化は宿主動物の行動パターンや分布域に影響を与えて新たな感染リスクを生み出す可能性があります。
| 環境要因 | 影響 |
|---|---|
| 森林開発 | 生息地の縮小 |
| 都市化 | 接触機会の増加 |
| 気候変動 | 生態系の変化 |
ウイルスの進化と適応
サル痘ウイルスの進化過程は宿主との共進化の歴史を反映しています。
遺伝子解析によりこのウイルスが長期にわたって様々な宿主に適応してきた過程が明らかになってきています。
ウイルスの変異と適応は新たな宿主への感染能力の獲得や環境抵抗性の変化につながる可能性があります。
このような進化的な変化は感染症の疫学的特徴に影響を与える不可欠な要素です。
特に注目すべき進化的特徴として以下のような点が挙げられます。
- 宿主特異性の獲得と変化
- 環境適応能力の向上
- 伝播効率の変化と最適化
人獣共通感染症としての特徴
エムポックスの人獣共通感染症としての性質は公衆衛生上の重要な課題です。
野生動物との接触による感染リスクは特に次のような状況で高まります。
- 狩猟活動や野生動物の取り扱い
- 感染動物との偶発的な接触
- 汚染された環境での活動
これらの状況における感染リスクの理解と対策は公衆衛生施策の重要な要素です。

画像診断と特徴的所見
エムポックスの画像診断において皮膚病変の形態学的特徴は診断の根幹をなす重要な指標として位置づけられています。
発疹の進行段階に応じて特徴的な画像所見が観察され、その分布や性状は病型によって異なる特徴を示すことが明らかになっています。
皮膚病変の画像特性
皮膚病変の画像診断ではデジタルダーマスコピーや高解像度カメラを用いた詳細な観察が補助的な手法となっています。
これらの機器を用いることで病変の中心陥凹などを確認するのに有用であり、微細な病変の特徴を捉えることが可能となり、より正確な診断を支援しています。
病変の形態学的特徴は発症からの時期によって刻々と変化することが知られており、その変化を経時的に追跡することは診断において極めて重要です。
特に初期段階での正確な評価はその後の経過観察において基準点となります。
皮膚表面の微細構造観察により病変の深さや性状を詳細に評価することが可能となっています。
真皮層における炎症反応の程度や、表皮の構造変化は高解像度画像によって明確に識別することができ、これらの情報は診断の確実性を高めています。
ただし、エムポックス診断の主軸は依然として臨床所見とPCR検査ですあることは忘れてはいけません。
| 画像検査法 | 主な観察対象 |
|---|---|
| ダーマスコピー | 表皮構造変化 |
| 高解像度カメラ | 病変全体像 |
| 蛍光観察 | 炎症範囲 |
病変の形態学的特徴
皮膚病変の形態は発症からの経過時間によって段階的な変化を示すことが特徴的です。
初期段階では境界明瞭な斑点状の変化として観察され、その後に丘疹、水疱、膿疱へと進行していく過程が画像上で確認できます。
これらの変化は病変部位の組織学的な変化を反映しており、表皮から真皮にかけての炎症反応の進行を示しています。
特に中心臍窩の形成は本疾患の特徴的な所見として認識されています。
- 初期病変 境界明瞭な紅斑性変化
- 進行期 中心臍窩を伴う水疱形成
- 後期 痂皮形成と治癒過程
形態学的変化の詳細な記録は病態の進行度評価や予後予測において不可欠な情報となります。
高解像度画像による継続的な観察によって個々の症例における病変の進行パターンを正確に把握することが可能となっています。
画像診断における鑑別ポイント
コンゴ盆地型(クレードⅠ)と西アフリカ型(クレードⅡ)の画像所見には明確な違いが認められます。
両型の違いは病変のサイズ、分布密度、中心臍窩の明瞭さなど複数の特徴によって判別することができます。
これらの特徴は画像診断技術の向上によってさらに明確に識別できるようになっています。
| 特徴 | コンゴ盆地型 | 西アフリカ型 |
|---|---|---|
| 病変サイズ | より大きい | 比較的小さい |
| 分布密度 | 高密度 | 中~低密度 |
| 中心臍窩 | 明瞭 | やや不明瞭 |
画像診断における鑑別ではこれらの特徴を総合的に評価することが求められます。
単一の所見のみではなく複数の特徴的所見を組み合わせて判断することで、より確実な診断が可能となります。
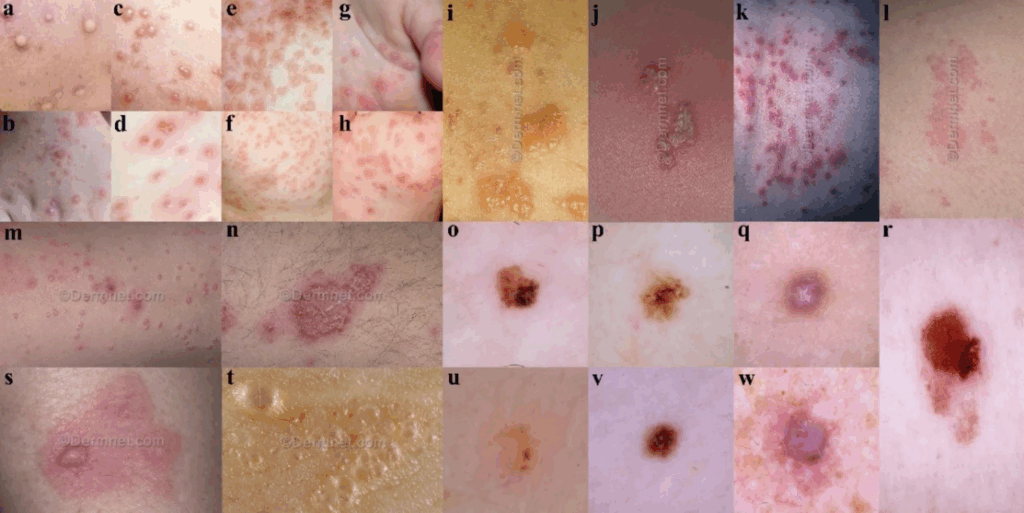
所見:「皮膚疾患のサンプル画像を示す。
(a–b) サル痘(Mpox)、(c–d) 水痘(Chickenpox)、(e–f) 麻疹(Measles)、(g–h) 手足口病(Hand, foot and mouth disease)、(i) 水疱性病変(Bullous)、(j) ウイルス感染(Viral infection)、(k) 細菌感染(Bacterial infection)、(l) 蕁麻疹(Urticaria)、(m) ヒトパピローマウイルス感染(HPV)、(n) 湿疹(Eczema)、(o) 日光角化症またはその亜型(AKIEC)、(p) 良性角化性病変(BKL)、(q) 皮膚線維腫(DF)、(r) 悪性黒色腫(MEL)、(s) 血管炎(Vasculitis)、(t) 血管腫瘍(Vascular tumor)、(u) 基底細胞癌(BCC)、(v) 母斑(NV)、(w) 血管病変(VASC)。」
画像所見の経時的変化
病変の進行過程を画像診断技術によって詳細に観察することは病態の理解と経過予測において極めて重要です。
各段階における特徴的な所見を理解して適切に評価することは診療上の判断において大きな意義を持ちます。
経時的変化の観察では病変の形態変化だけでなく周囲組織との関係性や炎症反応の程度なども含めて総合的に評価することが求められます。
これらの情報は病態の進行度を判断する上で貴重な指標となります。
- 発症初期 境界明瞭な紅斑性変化
- 進行期 水疱形成と中心臍窩の出現
- 後期 痂皮形成と瘢痕化
| 病期 | 主要画像所見 | 観察される時期 |
|---|---|---|
| 初期 | 紅斑 | 1-3日目 |
| 中期 | 水疱・膿疱 | 4-7日目 |
| 後期 | 痂皮 | 8-14日目 |
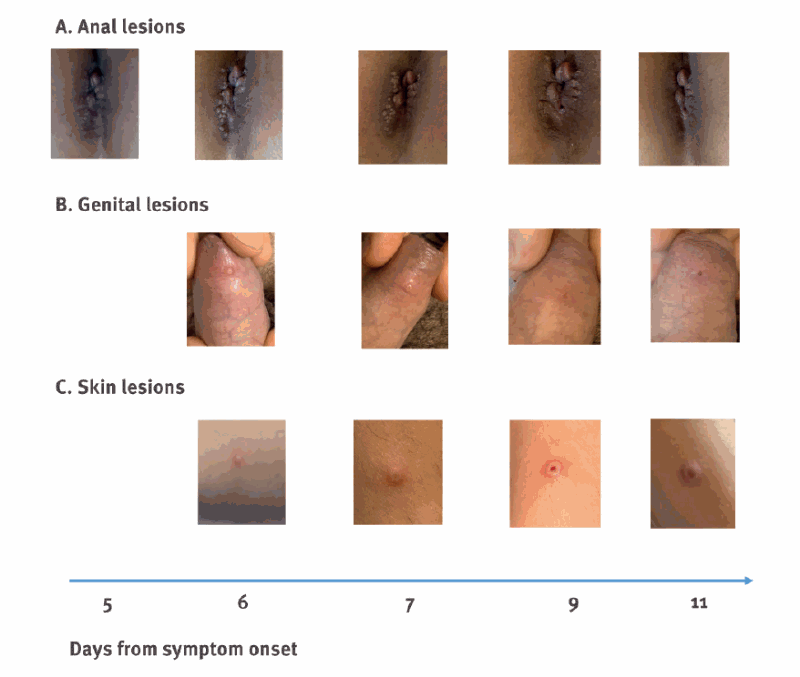
所見:「全身症状発現後1〜3日で病変が出現し、肛門周囲では集簇性(1A)、皮膚や陰茎では孤立性(1B–1C)に認められる。病変は初期に隆起性で掻痒を伴う小丘疹として出現し、漿液を分泌し、中央に臍窩様陥凹を呈する。数日後、この陥凹は拡大し、病変が開口した後、発症約2週間で痂皮形成に至る。」

治療アプローチと回復過程
エムポックスの治療においては症状の重症度や患者の状態に応じた包括的な医療介入が実施されます。
抗ウイルス薬の使用や支持療法によって多くの患者さんは2-4週間程度で回復に向かいます。
エムポックスの治療方針は世界共通で、病型(Clade)による明確な治療内容の違いはありません 。
ただし、中央アフリカ型(Clade I)は重症化しやすいため治療期間が長引く傾向がある、との指摘はあります。
治療の基本方針
エムポックスの治療では患者さんの全身状態を考慮した総合的なアプローチが重要です。
医療機関での経過観察を基本としながら症状の程度に応じて入院管理が検討されます。
特に免疫機能が低下している患者さんにおいてはより慎重な医療管理が必要となることが多く、継続的な観察が実施されます。
医療機関での管理体制は患者さんの状態に応じて柔軟に調整されます。
軽症例では外来での定期的な経過観察が基本となりますが、症状の変化に応じて入院管理への移行も検討されます。
| 治療区分 | 主な対象 | 管理体制 |
|---|---|---|
| 外来管理 | 軽症例 | 定期的な経過観察 |
| 入院管理 | 中等症・重症例 | 24時間体制の観察 |
治療方針の決定には患者さんの年齢や基礎疾患の有無、生活環境なども考慮されます。
特に高齢者や基礎疾患を有する患者さんではさらに慎重な管理が必要とされます。
2023年に発表された国際共同研究では、早期の治療介入群において入院期間の短縮と合併症の減少が報告されています。
この研究結果は治療開始のタイミングの重要性を示す貴重なエビデンスとなっています。
抗ウイルス薬による治療
抗ウイルス薬の投与は病状の進行を抑制する効果が期待されています。
投与のタイミングや期間は患者さんの状態や病型によって個別に判断されます。
テコビリマット(ST-246)はエムポックスウイルスの増殖を抑制する作用を持つ薬剤として注目されています。
臨床試験では早期投与群において症状の軽減と治癒期間の短縮が確認されています。
- テコビリマット(ST-246)
- シドフォビル
- ブリンシドフォビル
これらの薬剤の使用にあたっては患者さんの腎機能や肝機能などの検査値を定期的にモニタリングすることが求められます。
副作用の早期発見と対応も治療成功の鍵となります。
| 薬剤名 | 投与経路 | 標準的投与期間 |
|---|---|---|
| テコビリマット | 経口 | 14日間 |
| シドフォビル | 静脈内 | 7-10日間 |
抗ウイルス薬の選択には患者さんの状態や病型、さらには薬剤耐性の可能性なども考慮されます。
支持療法と対症療法
全身状態の維持と症状の緩和を目的とした支持療法は治療の基盤です。
水分・電解質バランスの管理や栄養管理など、基本的な医療ケアが不可欠です。
皮膚病変に対するケアも重要な要素となり、二次感染の予防や痛みの緩和を目的とした局所治療が実施されます。
特に皮膚病変の状態に応じた適切な外用薬の選択と使用方法の指導が重要です。
- 水分・電解質補給
- 栄養管理
- 皮膚病変のケア
- 疼痛管理
支持療法においては患者さんの全身状態を総合的に評価しながら必要な医療介入を適切なタイミングで実施することが求められます。
特に脱水や電解質異常の予防は重要な管理ポイントとなります。
治癒までの期間と経過観察
一般的な治癒までの期間は2-4週間程度とされていますが、個々の症例により差異が生じます。
病型による違いも認められ、コンゴ盆地型では西アフリカ型と比較してやや長期化する傾向です。
経過観察期間中は、定期的な診察と検査により、治療効果の判定と副作用のモニタリングが行われます。特に、皮膚病変の治癒過程は詳細に観察され、必要に応じて治療内容の調整が行われます。
| 病型 | 平均治癒期間 | 観察期間 |
|---|---|---|
| コンゴ盆地型 | 3-4週間 | 4-6週間 |
| 西アフリカ型 | 2-3週間 | 3-4週間 |
治癒過程の評価には皮膚病変の状態だけでなく全身症状の改善度や血液検査値の推移なども含めた総合的な判断が必要となります。
隔離解除の基準
隔離解除の判断は皮膚病変の治癒状態を主な指標として行われます。
エムポックス患者の隔離解除基準は、全ての病変の痂皮が自然脱落して新しい皮膚に置き換わった状態です。注意が必要なのは、痂皮がまだ付着している段階では解除しないということです。
隔離解除後も一定期間の経過観察が継続されることがあります。
特に免疫機能が低下している患者さんではより慎重なフォローアップが必要とされます。

治療における副作用とリスク管理
エムポックスの治療に使用される抗ウイルス薬や支持療法には様々な副作用やリスクが伴います。
特にテコビリマットやシドフォビルなどの抗ウイルス薬では消化器症状や腎機能障害などの副作用に細心の注意を払う必要があります。
病型によって副作用の発現頻度や程度に違いが見られ、コンゴ盆地型では西アフリカ型と比較してより慎重な経過観察が重要となります。
抗ウイルス薬による副作用
テコビリマットによる治療では消化器系の副作用が比較的高頻度で発現することが報告されています。
テコビリマット服用中に吐き気・下痢などの消化器症状が見られる患者は2~3割程度おり 、まれですが、症状強い場合は対症療法や休薬が必要です。
2023年に発表された国際共同研究ではテコビリマット投与患者の約35%に何らかの消化器症状が認められ、そのうち約15%で投与量の調整が必要であったことが報告されています。
この研究結果は副作用管理の重要性を示す貴重なエビデンスとなっています。
肝機能への影響も無視できない要素で、定期的な肝機能検査によるモニタリングが不可欠です。
特に基礎疾患として肝疾患を有する患者さんでは慎重な経過観察が求められます。
| 副作用 | 発現頻度 | 好発時期 |
|---|---|---|
| 消化器症状 | 30-40% | 投与開始後1-3日 |
| 肝機能障害 | 10-15% | 投与開始後1-2週間 |
消化器症状の管理においては食事内容の調整や制吐剤の使用など患者の状態に応じた対応が検討されます。
腎機能への影響
シドフォビルを使用する場合には腎機能障害のリスクについて特別な注意が必要です。
投与前後での腎機能検査が必須となり、腎機能の低下が認められた場合は投与量の調整や投与中止を検討します。
腎機能障害は投与開始後比較的早期から発現する可能性があるため定期的なモニタリングが欠かせません。
- 急性腎障害
- 電解質異常
- 尿細管障害
腎機能障害の予防には十分な水分摂取と適切な電解質バランスの維持が重要です。
投与前後での尿量モニタリングや電解質検査も必要不可欠な管理項目となります。
| 腎機能影響 | モニタリング頻度 | 注意事項 |
|---|---|---|
| 腎機能検査 | 週2-3回 | クレアチニン値上昇 |
| 電解質検査 | 週2回 | 電解質バランス異常 |
腎機能障害が発現した場合の対応として投与量の調整や投与間隔の延長、場合によっては代替薬への変更なども検討されます。
皮膚関連の副作用
局所治療に使用される外用薬により接触性皮膚炎や皮膚刺激症状が生じることがあります。
特に長期使用による皮膚萎縮や色素沈着などの副作用には注意が必要です。
皮膚バリア機能の低下は二次感染のリスクを高める可能性があります。
外用薬の使用方法や使用期間については慎重な管理が求められ、定期的な皮膚状態の評価が重要です。
| 皮膚症状 | 発現時期 | 対応策 |
|---|---|---|
| 接触性皮膚炎 | 使用開始数日後 | 外用薬の変更 |
| 皮膚萎縮 | 長期使用後 | 使用期間の制限 |
皮膚関連の副作用管理には保湿剤の併用や紫外線防御など予防的なケアも重要な要素となります。
患者教育を通じて適切なスキンケアの方法を指導することが推奨されます。
免疫系への影響
治療に伴う免疫系への影響は特に注意が必要な要素です。
免疫抑制状態にある患者さんでは日和見感染症のリスクが高まる可能性があり定期的な免疫機能の評価が必要となります。
免疫系への影響は治療期間中だけでなく治療終了後も一定期間継続する可能性があります。
そのため長期的な経過観察と感染予防対策の継続が重要となります。
- 日和見感染症
- 免疫反応の変化
- 自己免疫現象
免疫機能のモニタリングには定期的な血液検査や感染症スクリーニングが含まれます。
精神的・社会的影響
長期の治療や隔離による精神的ストレスは患者さんのQOLに大きな影響を与えることがあります。
不安やうつ状態、社会的孤立感などの問題が生じやすく、包括的な心理的サポートが必要です。
隔離期間中のストレス管理は治療の成功に関わる重要な要素です。
オンラインツールを活用したコミュニケーション支援や心理カウンセリングの提供など患者さんの精神的健康を支援する取り組みが求められます。
社会的影響への対応として職場や学校との連携も重要な課題となります。
復帰に向けた計画立案や必要な配慮事項の調整など患者さんの社会生活への円滑な復帰をサポートする体制が必要です。
後遺症への対応
一部の患者さんでは治癒後も瘢痕や色素沈着などが残存することがあります。
これらの後遺症に対しては皮膚科専門医による継続的なケアが提供されます。
瘢痕に対する治療は病変の完全な治癒を確認した後に開始されることが一般的です。
患者さんの希望や瘢痕の状態に応じて様々な治療選択肢が検討されます。
後遺症のケアにおいては患者さんの心理的なサポートも重要な要素です。
特に外見的な変化が残る場合には患者さんの社会生活への影響も考慮した包括的なサポートが必要となります。
瘢痕治療には外用薬による保存的治療からレーザー治療などの医療機器を用いた治療まで様々なアプローチが存在します。
治療法の選択には瘢痕の状態や患者の希望、医療機関の設備などが考慮されます。
色素沈着に対しては紫外線防御を含めた予防的なケアが重要です。
日光暴露を避けて適切な日焼け止めを使用することで色素沈着の悪化を防ぐことができます。
後遺症の治療には長期的な視点が必要であり、患者さんとの十分なコミュニケーションを通じて現実的な治療目標を設定することが求められます。
医療者は患者さんの期待と医学的な可能性のバランスを考慮しながら治療計画を立案します。
薬物相互作用のリスク
他の薬剤との相互作用により予期せぬ副作用が発現することがあります。
特に抗ウイルス薬と他の薬剤との併用には慎重な評価が必要となり、薬剤師との連携による詳細な薬歴確認が推奨されます。
基礎疾患のために継続的に服用している薬剤がある場合はそれらとの相互作用について詳細な確認が求められます。
例えば抗凝固薬や免疫抑制剤との併用では効果の増強や減弱に注意が必要です。
薬物相互作用の管理には定期的な薬剤評価と必要に応じた用量調整が含まれます。
特に多剤併用している患者さんではより慎重な管理が求められ、副作用モニタリングの頻度を増やすことも検討されます。
年齢層による副作用リスクの違い
高齢者では薬物代謝能の低下や臓器予備能の減少によって副作用が重症化しやすい傾向です。
また、基礎疾患を有する割合が高く、薬物相互作用のリスクも増加します。
若年者では一般的に副作用への耐性が高いとされていますが、長期的な影響については十分なデータが蓄積されていない面もあります。
特に生殖年齢層での使用については慎重な評価が必要です。
小児における副作用プロファイルは成人とは異なる特徴を示すことがあります。
体重あたりの投与量調整や年齢に応じた副作用モニタリングの方法を検討する必要があります。
副作用モニタリングの実際
副作用の早期発見には定期的な診察と検査が重要な役割を果たします。
血液検査や画像検査などの客観的評価に加えて患者さんの自覚症状についても丁寧な聴取が必要です。
モニタリングの頻度は患者さんの状態や使用薬剤によって個別に設定されます。
特に治療開始初期や用量調整時にはさらに頻回な評価が推奨されます。
副作用が発現した場合の対応手順をあらかじめ患者とさん.共有しておくことも重要です。
緊急時の連絡方法やセルフケアの方法について具体的な指導を行います。
副作用への予防的アプローチ
副作用の予防には投与前のリスク評価が重要な役割を果たします。
基礎疾患の有無や併用薬の確認、過去の副作用歴などを詳細に評価して個々の患者さんに適した予防策を検討します。
予防的な投薬や生活指導を通じて副作用のリスクを軽減することが可能な場合もあります。
特に消化器症状や皮膚症状については予防的な対策が有効です。

エムポックスの治療費について
エムポックスの治療には抗ウイルス薬テコビリマットを中心とした薬物療法が実施されます。
治療期間は通常2週間から4週間程度で薬剤費用に加えて入院費用や検査費用が発生します。
医療機関や治療内容によって費用は異なりますが、一般的な治療費用の目安を解説します。
処方薬の薬価
テコビリマットは2024年12月6日に薬事承認されましたが、2025年9月において、薬価は現在決められていません。
使用用法としては、1回カプセル、1日2回の服用が基本となります。
投与期間は症状の重症度により異なりますが14日間の処方が一般的です。
| 薬剤名 | 1日あたりの薬価 | 14日間の薬価 |
|---|---|---|
| テコビリマット | – 円 | – 円 |
| 支持療法薬 | 3,000円 | 42,000円 |
1週間の治療費
外来診療の場合での診察料や検査料を含めた1週間の医療費は約2万〜20万円前後となります。
入院治療の場合は入院基本料や管理料などが加算されます。
- 外来診察料 1,000〜5,000円/回
- 血液検査 5,000〜15,000円/回
- 画像検査 10,000〜30,000円/回
- 処置料 1,000〜8,000円/回
1か月の治療費
症状が重症化した場合や合併症が発生した際は入院期間が延長し治療費が増加します。
個室使用料や特別な治療が必要な場合には追加費用が発生することがあります。
| 治療内容 | 概算費用 |
|---|---|
| 外来治療 | 30-100万円 |
| 入院治療 | 150-200万円 |
以上