呼吸器疾患の一種である小細胞肺癌(しょうさいぼうはいがん)とは、私たちの体にとって重要な臓器である肺に発生する悪性腫瘍の一つです。
小細胞肺癌は顕微鏡で観察すると小さな細胞の集まりとして確認されますが、その影響は非常に深刻です。他の肺がんと比較して進行が速く、急速に広がる可能性があります。
そのため早期発見が非常に重要ですが、初期症状が風邪と似ていることもあり見逃されやすいのも特徴です。
小細胞肺癌の病型
小細胞肺癌の病型分類は患者さんの状態を正確に評価し、個別化された対応を検討する上で極めて重要な要素です。
限局型と進展型:基本的な分類
小細胞肺癌の病型は主に限局型と進展型の2つに大別されます。この分類は癌の広がりの程度を示す指標として広く用いられています。
| 病型 | 定義 |
| 限局型 | がんが一側の胸郭内に限局している状態 |
| 進展型 | がんが胸郭の外側にまで広がっている状態 |
病型分類の臨床的意義
小細胞肺癌の病型分類は単なる分類に留まらず、患者さんの予後予測や治療方針の決定において中核的な役割を果たすのです。
- 限局型: • 局所治療の可能性 • 放射線療法の検討
- 進展型: • 全身治療の必要性 • 新規治療法の検討
適切な病型分類により個々の患者さんに最適化された治療アプローチの選択が可能となります。
小細胞肺癌の主症状
小細胞肺癌の症状は多様で個人差が大きいという特徴があります。発症すると進行が速いため、症状が持続する場合には躊躇せずに専門医による適切な評価を受けることが大切です。
呼吸器系の症状
小細胞肺癌の最も顕著な症状は呼吸器系に関連するものです。特に持続的な咳は多くの患者さんが経験する初期症状の一つであり、3週間以上続く場合には注意しましょう。
| 症状 | 特徴 | 日常生活への影響 |
| 咳 | 持続的、悪化傾向 | 睡眠障害、社会生活の制限 |
| 呼吸困難 | 徐々に進行 | 運動能力の低下、不安感の増大 |
| 胸痛 | 深呼吸時に増強 | 日常動作の制限、不快感 |
息切れや呼吸困難は癌の進行に伴って徐々に悪化する傾向があり、階段の昇降や長距離の歩行などの日常動作に支障をきたす可能性があります。
全身症状
小細胞肺癌は呼吸器系の症状だけでなく、全身に影響を及ぼす症状を引き起こすことがあります。以下のような症状は患者さんの年齢や性別によって異なる現れ方をする場合が多いです。
- 体重減少:1ヶ月で5%以上の減少も
- 疲労感:日中の活動性が低下し、休息が多く必要に
- 食欲不振:栄養状態の悪化につながる
- 発熱:37.5度以上の微熱が持続することも
高齢の患者さんではこれらの症状がより顕著に現れる傾向があり、日常生活の自立度に大きな影響を与える可能性もでてくるでしょう。
神経系の症状
小細胞肺癌は神経系にも影響を与える傾向があり、患者さんの生活機能に直接的な影響を及ぼす可能性が高いです。
| 症状 | 原因 | 生活への影響 |
| 複視 | 脳転移 | 読書や運転の困難 |
| 筋力低下 | 脊髄圧迫 | 歩行障害、日常動作の制限 |
| 感覚異常 | 末梢神経障害 | 細かい作業の困難、転倒リスクの増加 |
これらの症状は患者さんの自立した生活を脅かす可能性があります。
傍腫瘍症候群
小細胞肺癌の特徴的な症状として傍腫瘍症候群が挙げられます。これらの症候群は癌の早期段階でも現れることがあり、診断の重要な手がかりとなるケースも多いです。
- 抗利尿ホルモン不適切分泌症候群(SIADH):低ナトリウム血症による頭痛や嘔吐
- クッシング症候群:満月様顔貌、中心性肥満
- ランバート・イートン筋無力症候群:筋力低下、特に下肢の脱力
これらの症候群は患者さんの生活の質に大きな影響を与える可能性があるため適切な管理が不可欠です。
症状の自己管理
小細胞肺癌の症状に対しては患者さん自身による適切な自己管理が重要です。
- 日々の症状の変化を記録する
- 呼吸法や姿勢の工夫で呼吸困難を軽減する
- 適度な運動と休息のバランスを取る
- バランスの取れた栄養摂取を心がける
これらの自己管理策は症状の軽減や生活の質の維持に役立つ可能性があります。
小細胞肺癌の原因とリスク要因
小細胞肺癌の発症には複数の要因が複雑に絡み合っており、その全容の解明には更なる研究が必要です。
喫煙が最大のリスク要因であることは広く認識されていますが、それ以外にも環境因子や遺伝的要因など様々な要素が関与しています。
喫煙
喫煙は小細胞肺癌の発症リスクを著しく高める最も重要な要因です。
タバコの煙に含まれる4000種類以上の化学物質のうち少なくとも50種類が発がん性を持つとされており、これらが肺の細胞に直接的なダメージを与えてがん化を促進すると考えられています。
| 喫煙状況 | 相対リスク | 絶対リスク(10万人年あたり) |
| 非喫煙者 | 1.0 | 2-5 |
| 現在喫煙者 | 15-30 | 60-150 |
| 過去喫煙者 | 3-5 | 10-25 |
喫煙期間や喫煙量が増えるほど小細胞肺癌のリスクも上昇する傾向です。1日の喫煙本数が20本を超える重度喫煙者は非喫煙者と比較すると60倍以上のリスクがあるとする研究もあります。
職業的暴露
職業上の有害物質への暴露も小細胞肺癌の発症リスクを高める重要な要因です。特に以下のような物質への長期的な暴露が問題視されています。
- アスベスト:建設業や造船業などで使用され、肺がんリスクを5倍以上に増加させる
- ラドン:地下鉱山労働者に多く、累積暴露量に応じてリスクが上昇
- ヒ素:金属精錬や農薬製造に関わる労働者で高リスク
- クロム・ニッケル:金属加工業や溶接作業者でリスクが上昇
これらの物質に職業上で接触する機会が多い職種では小細胞肺癌のリスクが高まる可能性があるでしょう。
例えばアスベスト暴露労働者では非暴露者と比較して肺がん全体のリスクが2-5倍に上昇するという報告があります。
遺伝的要因
遺伝的要因も小細胞肺癌の発症に重要な役割を果たしているのです。特定の遺伝子変異や多型ががんの発症リスクを高めるとされています。
| 遺伝子 | 関連するリスク | 環境因子との相互作用 |
| TP53 | がん抑制機能の低下 | 喫煙により変異リスク上昇 |
| RB1 | 細胞周期制御の異常 | 職業的発がん物質で不活化促進 |
| PTEN | シグナル伝達の異常 | 大気汚染との複合効果 |
これらの遺伝子の変異や機能異常が小細胞肺癌の発症メカニズムに関与していると考えられています。
注目すべきはこれらの遺伝的要因が環境因子と相互作用することで、リスクが更に高まる可能性があるという点です。
例えばTP53遺伝子の特定の多型を持つ個人が喫煙者である場合、そのリスクは非喫煙者の2-3倍に上るという研究結果があります。
年齢と性別
小細胞肺癌の発症リスクは年齢と性別によっても異なることが知られています。
- 年齢:50歳以上で急激にリスクが上昇し、70歳代でピークを迎える
- 性別:男性の方が女性よりも1.5-2倍高いリスク
| 年齢層 | 男性の発症率(10万人あたり) | 女性の発症率(10万人あたり) |
| 40-49歳 | 2-5 | 1-3 |
| 50-59歳 | 15-20 | 10-15 |
| 60-69歳 | 40-50 | 25-35 |
| 70歳以上 | 60-70 | 40-50 |
これらの差異は喫煙習慣の違いだけでなく、ホルモンバランスや遺伝子発現の性差なども影響していると考えられているのです。
複合的要因
小細胞肺癌の発症には上記の要因が単独で作用するだけでなく複数の要因が相互に作用し合うことで相乗的なリスク上昇が起こる可能性があるのです。
例えば喫煙者が職業的にアスベストに暴露されると、そのリスクは各要因単独の場合の和以上に高まることが知られています。
- 喫煙 + アスベスト暴露:リスクが50-90倍に上昇
- 喫煙 + ラドン暴露:リスクが20-30倍に上昇
- 遺伝的素因 + 環境因子:個人差が大きいが、2-10倍のリスク上昇
このような複合的な要因の相互作用を理解することが小細胞肺癌の発症メカニズムを解明し、効果的な予防策を講じる上で不可欠です。
診察と診断
小細胞肺癌の診察と診断は、複数のステップを経て慎重に行われる精密な医療プロセスです。早期発見と正確な診断が予後に大きく影響するため、多角的なアプローチが不可欠となります。
診断の各段階で得られた情報を統合して多職種による協議を経て、最終的な診断と治療方針が決定されるのです。
問診と身体診察:診断の第一歩(所要時間:)
診断プロセスは詳細な問診と綿密な身体診察から始まります。問診では患者さんの既往歴、家族歴、職業歴などを丁寧に聴取し、潜在的なリスク要因を評価します。
| 問診項目 | 評価ポイント | 患者さんへの配慮 |
| 喫煙歴 | 喫煙期間、本数 | 非難せず、客観的に聴取 |
| 職業歴 | 有害物質への暴露 | プライバシーに配慮 |
| 家族歴 | 遺伝的要因の可能性 | 心理的負担に留意 |
身体診察では聴診器を用いた肺音の評価や、リンパ節の腫脹の有無などを慎重に確認しなければなりません。
この過程は患者さんに身体的な負担をかけることはほとんどなく、所要時間は30分〜1時間程度です。
画像診断
画像診断は病変を可視化できるため小細胞肺癌の診断において重要な役割を果たします。各検査の特徴と患者さんへの負担は以下の通りです。
| 問診項目 | 所要時間 | 被曝量 | 詳細 |
|---|---|---|---|
| 胸部X線 | 約5分 | 0.1mSv程度 | 立位または座位で撮影 |
| 胸部CT | 10〜20分 | 5-10mSv程度 | 横臥位で15分程度の静止が必要 |
| PET-CT | 2〜3時間(待機時間含む) | 10-25mSv程度 | 長時間の静止と絶食が必要 |
これらの画像検査から腫瘍の位置、大きさ、周囲組織への浸潤の程度などを詳細に評価することが可能となります。画像診断の精度は高く、CT検査の感度は90%以上、特異度は70-80%程度です。
生検
画像検査で異常が疑われた場合、確定診断のために生検が行われます。生検方法は腫瘍の位置や患者さんの状態によって選択されるでしょう。
| 生検方法 | 特徴 | 患者さんへの負担 | 精度 |
| 気管支鏡下生検 | 中心型の腫瘍に適する | 中程度(局所麻酔で実施) | 感度80-90% |
| CTガイド下生検 | 末梢型の腫瘍に適する | やや高い(穿刺による痛みあり) | 感度90%以上 |
| 手術的生検 | より大きな組織片が必要な場合 | 高い(全身麻酔が必要) | 感度95%以上 |
生検で得られた組織は病理医によって顕微鏡下で詳細に観察され小細胞肺癌の確定診断が行われ、所要時間は30分~2時間程度です。
生検での病理診断の精度は非常に高く、確定診断における感度と特異度はともに95%以上です。
病期診断
小細胞肺癌の診断が確定したら病期診断を行い適切な治療方針を決定します。それぞれ固有の特徴と患者さんへの負担度合が異なる様々な検査が組み合わせて用いられのが病期診断です。
- 胸部CT:局所進展の評価(前述)
- 脳MRI:脳転移の評価 • 所要時間:30〜60分 • 患者負担:中程度(閉所恐怖症の方は要相談)
- 骨シンチグラフィ:骨転移の評価 • 所要時間:3〜4時間 • 患者負担:低い(放射性医薬品の注射が必要)
- PET-CT:全身の転移巣の評価(前述)
上記の検査結果を総合的に判断し、TNM分類に基づいて病期が決定されるまでには1~2週間かかります。
病期診断の精度は使用する検査の組み合わせにより異なりますが、一般的に80-90%程度の正確性でしょう。
分子生物学的検査
近年、分子生物学的検査の重要性が増しています。この検査により腫瘍の遺伝子変異や特定のバイオマーカーの発現状況を評価し、さらに個別化した治療方針の決定に役立てることができるのです。
| 検査項目 | 評価対象 | 精度 |
| EGFR遺伝子変異 | 分子標的薬の適応 | 感度95%以上 |
| ALK融合遺伝子 | 分子標的薬の適応 | 感度90%以上 |
| PD-L1発現 | 免疫チェックポイント阻害薬の効果予測 | 感度85-90% |
検査後結果が出るまでには1~2週間程度かかりますが、患者さん個々の腫瘍の特性を理解した最適な治療法を選択する上で大切な情報となります。
多職種カンファレンスと診断結果の説明
全ての検査結果が揃った後、呼吸器内科医、放射線科医、病理医、腫瘍内科医、外科医などの専門家によるカンファレンスが開催されます。
ここで各検査結果の詳細な解釈と、総合的な診断および治療方針の検討が行われるのです。
こうしてカンファレンスの結果を踏まえたうえで診断結果と推奨される治療方針の説明があります。
小細胞肺癌の画像所見
小細胞肺癌の画像所見は診断において中核的な役割を果たします。各種画像検査で観察される特徴的な所見が正確な診断と適切な治療方針の決定に不可欠です。
複数の画像モダリティを組み合わせることで、より精度の高い評価が可能となります。
胸部X線検査所見
胸部X線検査は小細胞肺癌の初期スクリーニングとして広く用いられています。この検査では肺門部の腫大や縦隔の拡大といった特徴的な所見が観察されるのです。
| 所見 | 特徴 | 感度 | 特異度 |
| 肺門部腫大 | 片側性または両側性 | 60-70% | 75-85% |
| 縦隔拡大 | リンパ節転移を示唆 | 50-60% | 80-90% |
| 肺野の腫瘤影 | 境界不明瞭な場合が多い | 70-80% | 65-75% |
しかし胸部X線検査では小さな病変を見逃す可能性があるため他の画像検査と組み合わせて評価することが大切です。特に2cm以下の小病変の検出感度は30-40%程度と低くなります。
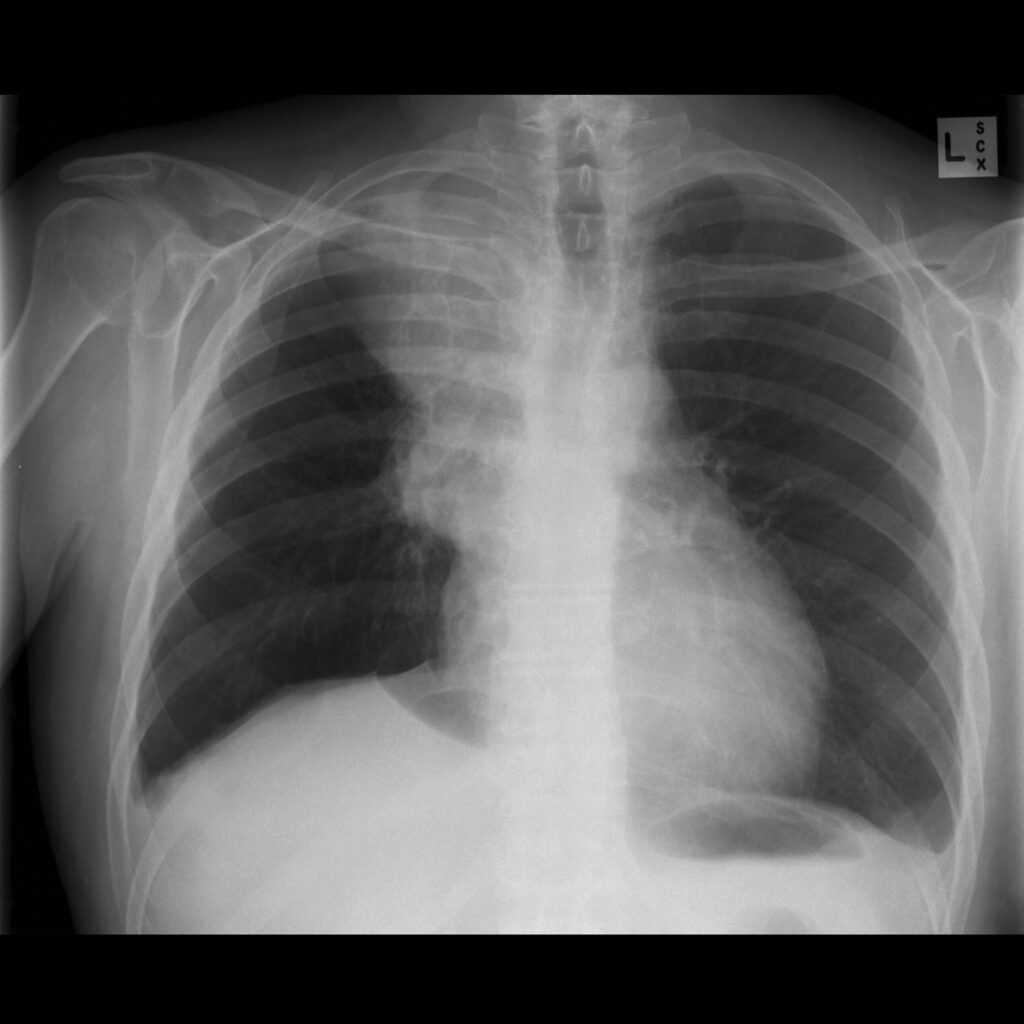
所見:右肺門部の腫瘤に伴う右上葉の虚脱と一致する浸潤影を認める。Juxtaphrenic peak signも認められる。右上葉の虚脱と肺門部腫瘤はGolden’s S signの構成要素であり、形状は特にS字型ではないものの、これらの所見が合致している。
胸部CT検査所見
胸部CT検査は小細胞肺癌の詳細な評価に欠かせない検査方法です。高解像度のCT画像から腫瘍の位置、大きさ、周囲組織への浸潸の程度を正確に把握することができます。
小細胞肺癌のCT所見として挙げられる特徴は以下の通りです。
- 中心性の腫瘤影(感度:90-95%、特異度:70-80%)
- 気管支壁の肥厚や狭窄(感度:85-90%、特異度:75-85%)
- 肺門部および縦隔リンパ節の腫大(感度:80-85%、特異度:70-80%)
- 胸水貯留(感度:60-70%、特異度:80-90%)
これらの所見は小細胞肺癌の診断において重要な手がかりとなります。末梢型の腺癌と異なり、小細胞肺癌では中心性の発生が多い傾向があるので他の肺癌との鑑別が可能になるのです。
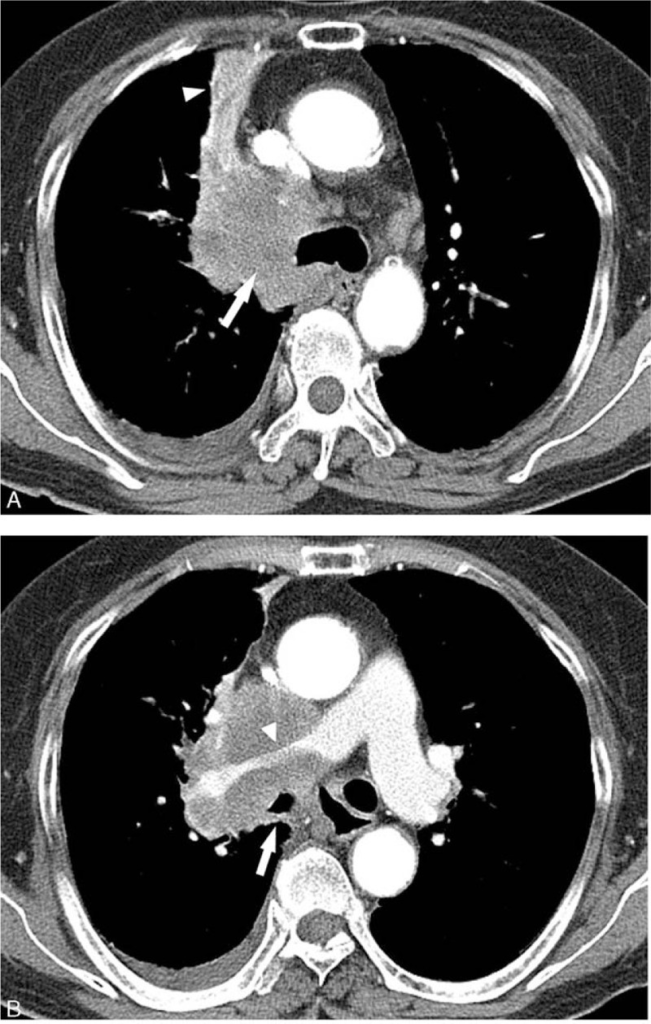
所見:79歳女性SCLC(小細胞肺癌)タイプIIbの症例。(A)右肺門部に同側肺門・縦隔リンパ節とも一塊となった腫瘤を認める。腫瘤は右上葉気管支(白矢印)を閉塞し、右上葉の無気肺(白い矢頭)を引き起こしている。(B) 腫瘤が中間気管支(白矢頭)および右主肺動脈(白矢頭)を包み込み、狭窄を引き起こしている。
PET-CT検査所見
PET-CT検査は小細胞肺癌の全身評価に有用な検査方法です。FDG(フルオロデオキシグルコース)という放射性薬剤を用いて、がん細胞の代謝活性を可視化します。
| 所見 | 意義 | 感度 | 特異度 |
| 原発巣の高集積 | 腫瘍の活動性を示唆 | 95-98% | 80-85% |
| リンパ節への集積 | 転移の可能性を示唆 | 85-90% | 80-85% |
| 遠隔臓器への集積 | 遠隔転移の可能性を示唆 | 90-95% | 85-90% |
PET-CT検査は小細胞肺癌の病期診断や治療効果判定において極めて重要な役割を果たします。特に従来のCT検査では検出が難しい微小転移巣の評価に優れてるでしょう。
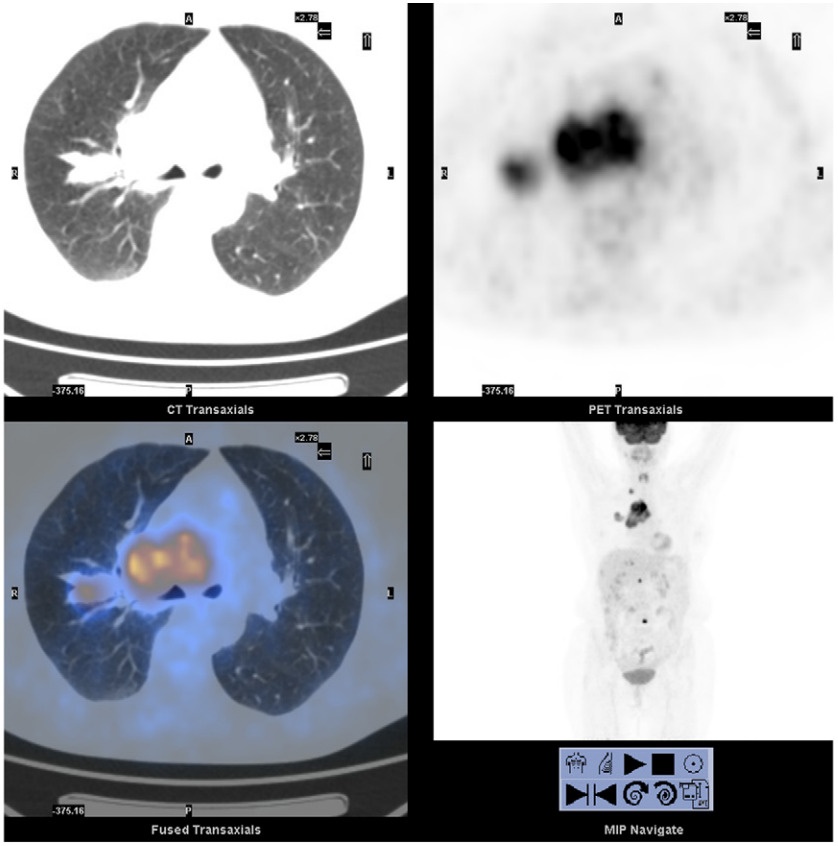
所見:SCLC患者の18F-FDG PET/CT像。左肺門部に腫瘤を認め、複数の高代謝性リンパ節および複数の骨病変を認める。
MRI検査所見
MRI検査は、小細胞肺癌の脳転移評価に特に有用です。小細胞肺癌は脳転移を起こしやすい特徴があるため、初期診断時からMRIによる脳の評価が行われることが多いです。
脳MRIでの小細胞肺癌転移巣の特徴的所見
- T1強調画像:低信号(感度:95-98%、特異度:90-95%)
- T2強調画像:高信号(感度:98-99%、特異度:85-90%)
- 造影T1強調画像:リング状または結節状の増強効果(感度:99%以上、特異度:95-98%)
これらの所見を注意深く評価することで脳転移の早期発見と適切な治療方針の決定に役立てることができます。
MRIは1mm以下の微小転移巣も検出可能で、CT検査よりも優れた感度を示してくれるのです。
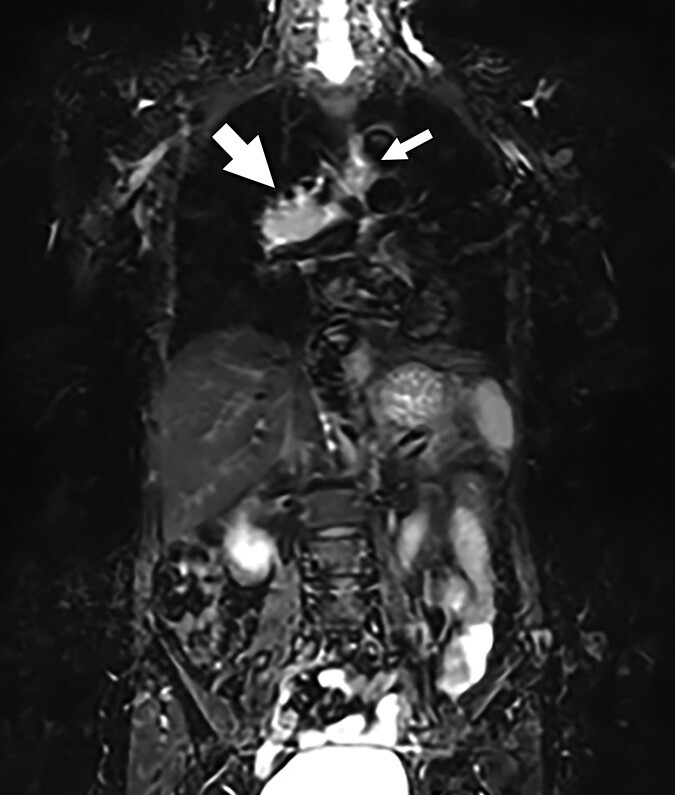
所見:病理学的に小細胞肺癌(SCLC)と診断された68歳女性。 冠状断面STIR像では、右肺門部の原発巣(太矢印)は右主気管支への浸潤が疑われ、TカテゴリーはT3と評価される。同側の縦隔リンパ節(細矢印)は転移が疑われ、NカテゴリーはN2と評価される。
骨シンチグラフィ所見
骨シンチグラフィは小細胞肺癌の骨転移評価に用いられる検査方法です。放射性同位元素を用いて骨代謝の亢進している部位を可視化します。
| 所見 | 解釈 | 感度 | 特異度 |
| 多発性の集積亢進 | 骨転移の可能性が高い | 90-95% | 60-70% |
| 単発性の集積亢進 | 良性病変との鑑別が必要 | 80-85% | 70-80% |
骨シンチグラフィの所見は小細胞肺癌の病期診断や治療方針の決定に重要な情報をもたらします。
ただし特異度が比較的低いため、陽性所見の場合は他の画像検査(MRIやCT)で確認することが推奨されます。
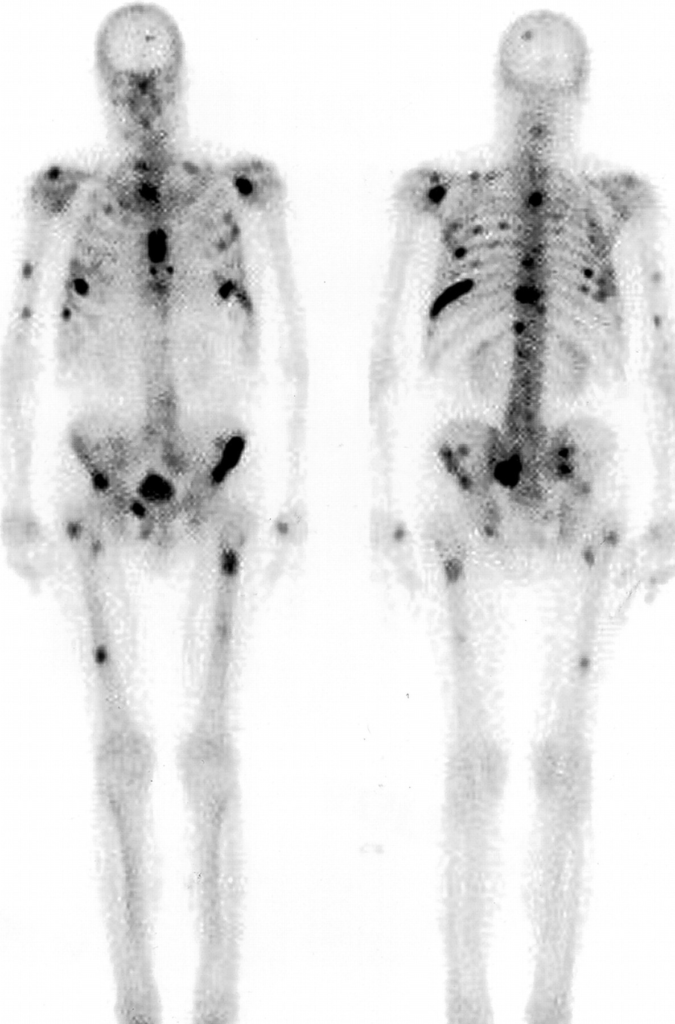
所見:前面(左)・後面(右)の全身骨シンチグラムでは、多発骨転移病変疑う集積亢進が全身に散見される。
経時的画像評価
小細胞肺癌の画像所見は経時的な評価が極めて重要です。治療開始後に腫瘍の縮小や消失が観察されれば治療効果があると判断されます。
一方、新たな病変の出現や既存病変の増大は当然ながら病勢の進行や再発を示唆しています。
経時的評価では各モダリティの特性を考慮して適切な間隔で検査を行うことが大切です。
画像診断の限界と注意点
画像診断は小細胞肺癌の評価において非常に有用ですが、以下のような限界や注意点があります。
- 微小病変の検出限界:各モダリティには検出限界があり、それ以下の病変は見逃される可能性も
- 偽陽性・偽陰性:炎症性変化や良性腫瘍が小細胞肺癌と誤認、逆に小細胞肺癌が見逃される場合も
- 被ばく:CT検査やPET-CT検査では放射線被ばくを伴う
- 造影剤関連の問題:造影剤使用に伴うアレルギー反応や腎機能障害のリスクがあります。
これらの限界を認識したうえで、複数のモダリティを組み合わせた総合的な評価を行うことが重要です。
治療方法と薬、治癒までの期間
小細胞肺癌の治療は化学療法を中心とした複合的なアプローチが基本となります。治療法の選択は病期や患者さんの全身状態に応じて個別化され、治癒までの期間も症例によって大きく異なります。
最新のエビデンスに基づいた治療選択と患者さんの生活の質を考慮したアプローチが重要です。
化学療法
化学療法は小細胞肺癌治療の要となります。一般的に白金製剤(シスプラチンまたはカルボプラチン)とエトポシドの併用療法が標準的なレジメンとして用いられます。
| 薬剤 | 投与方法 | 主な副作用 | 奏効率 |
| シスプラチン+エトポシド | 3週間毎、4-6サイクル | 骨髄抑制、悪心・嘔吐 | 60-80% |
| カルボプラチン+エトポシド | 3週間毎、4-6サイクル | 骨髄抑制、疲労感 | 60-70% |
化学療法の効果は個人差が大きいですが、多くの場合2-3サイクル後には腫瘍の縮小が確認されるでしょう。限局型小細胞肺癌では化学療法単独で約50%の完全奏効率が報告されています。
放射線療法
限局型小細胞肺癌では化学療法と放射線療法の併用(同時化学放射線療法)が標準的治療です。放射線療法は腫瘍の局所制御に有効で、5年生存率を約5%向上させる効果が報告されています。
放射線療法の特徴は次の通りです。
- 1日1回、週5日のペースで実施
- 総線量45〜60Gy程度を25〜30回に分割して照射
- 治療期間は5〜6週間程度
- 局所制御率:約70-80%
免疫チェックポイント阻害薬
近年、免疫チェックポイント阻害薬が小細胞肺癌の治療に導入されて従来の化学療法との併用によって治療成績の向上が期待されています。
| 薬剤名 | 作用機序 | 主な副作用 | 奏効率(化学療法併用時) |
| アテゾリズマブ | PD-L1阻害 | 自己免疫関連有害事象 | 60-70% |
| デュルバルマブ | PD-L1阻害 | 自己免疫関連有害事象 | 65-75% |
これらの薬剤は化学療法との併用で全生存期間の延長が示されています(中央値で2-3ヶ月程度の改善)。
治療効果の評価と二次治療
初回治療後の効果判定は通常2〜3サイクル終了後に画像検査などで行われます。RECIST基準に基づく効果判定が一般的です。
| 効果判定 | 定義 | 頻度 |
| 完全奏効(CR) | 全ての病変が消失 | 15-25% |
| 部分奏効(PR) | 腫瘍径の30%以上の縮小 | 40-50% |
| 安定(SD) | PRとPDの中間 | 20-30% |
| 進行(PD) | 腫瘍径の20%以上の増大 | 5-10% |
二次治療の選択基準は以下の通りです。
- 初回治療からの期間(3ヶ月以内か否か)
- 患者の全身状態(PS)
- 前治療の反応性
- 合併症の有無
二次治療の選択肢と期待される効果
- トポテカン単剤療法:奏効率 15-20%、無増悪生存期間中央値 3-4ヶ月
- アムルビシン単剤療法:奏効率 20-30%、無増悪生存期間中央値 3-5ヶ月
- 免疫チェックポイント阻害薬:奏効率 10-20%、無増悰生存期間中央値 2-3ヶ月
予防的全脳照射
小細胞肺癌は脳転移を起こしやすい特徴があるため化学療法で効果が得られた患者さんには予防的全脳照射が検討されます。
これにより、脳転移のリスクを約25%低減させて1年生存率を約5%向上させる効果が報告されているのです。
| 照射方法 | 総線量 | 期間 | 脳転移予防効果 |
| 1日1回 | 25Gy | 10回 | 約60-70% |
| 1日2回 | 30Gy | 15回 | 約65-75% |
ただし、認知機能への影響が懸念されるため、実施の是非は慎重に検討される必要があります。
治癒までの期間と長期予後
小細胞肺癌の治癒までの期間は個々の症例により大きく異なりますが、標準的な治療期間と予後の目安は以下の通りです。
| 病型 | 初回治療期間 | 中央生存期間 | 5年生存率 |
| 限局型小細胞肺癌 | 約3-4ヶ月 | 16-24ヶ月 | 15-25% |
| 進展型小細胞肺癌 | 約4-6ヶ月 | 8-13ヶ月 | 1-5% |
完全寛解が得られても2年以内の再発率が高いことが知られていますが、5年間再発がない場合は長期生存の可能性が高くなります。
臨床試験と新規治療法の動向
小細胞肺癌の治療成績向上を目指して様々な臨床試験が進行中です。主な注目分野は以下の通りです。
- 新規免疫チェックポイント阻害薬の開発
- 抗体薬物複合体(ADC)の臨床応用
- PARP阻害剤の有効性評価
- CAR-T細胞療法の小細胞肺癌への応用
これらの新規治療法は、従来の治療に抵抗性を示す症例や再発症例に対する新たな選択肢となる可能性があります。
| 治療法 | 期待される効果 | 開発段階 |
| PARP阻害剤 | DNA修復阻害による腫瘍増殖抑制 | Phase II/III |
| ADC (DLL3標的) | 腫瘍特異的な薬物送達 | Phase II |
| Bi-specific抗体 | T細胞の活性化と腫瘍細胞認識 | Phase I/II |
臨床試験への参加は新しい治療法へのアクセスの機会となる一方で未知の副作用のリスクも伴います。患者さんの状態や希望を十分に考慮し、慎重に検討する必要があります。
治療選択の意思決定プロセス
小細胞肺癌の治療方針決定には多職種によるカンファレンスと患者さんとの十分な対話が不可欠です。以下のステップで進められます。
- 病期・全身状態の評価
- 標準治療オプションの提示
- 期待される効果と予想される副作用の説明
- 患者さんの価値観・希望の確認
- 治療目標の共有(根治、延命、症状緩和など)
- 最終的な治療方針の決定
この過程でセカンドオピニオンの活用やアドバンス・ケア・プランニングの導入も検討されるでしょう。
副作用とリスク
小細胞肺癌の治療には様々な副作用やリスクが伴います。これらの副作用は患者さんのQOLに大きな影響を与える可能性があるため、適切な理解と管理が不可欠です。
副作用の早期発見と適切な対応が治療の継続性と患者さんの生活の質の維持に重要な役割を果たします。
化学療法関連の副作用
化学療法は小細胞肺癌治療の中心的役割を果たしますが、同時に多様な副作用をもたらす可能性も秘めているのです。
| 副作用 | 頻度 | 重症度 (CTCAE v5.0) | 主な管理方法 |
| 骨髄抑制 | 70-80% | Grade 3-4: 20-30% | G-CSF製剤、輸血 |
| 悪心・嘔吐 | 60-70% | Grade 3-4: 10-15% | 制吐剤の予防投与 |
| 脱毛 | 90%以上 | Grade 2: 80%以上 | 頭皮冷却法 |
骨髄抑制は特に注意が必要で、感染症のリスクを高めるだけでなく、貧血による倦怠感や血小板減少による出血傾向を引き起こすことがあります。
骨髄抑制の管理
- 好中球減少:G-CSF製剤の予防的投与(特にリスクの高い患者)
- 貧血:エリスロポエチン製剤の使用、必要に応じて輸血
- 血小板減少:血小板輸血、出血リスクの高い行為を避ける指導
悪心・嘔吐の管理
- 5-HT3受容体拮抗薬とデキサメタゾンの併用
- NK1受容体拮抗薬の追加(高度催吐性レジメンの場合)
- 食事指導(少量頻回摂取、冷たい食品の摂取など)
放射線療法に伴うリスク
放射線療法は局所制御に有効ですが、照射部位周辺の正常組織にダメージを与えるリスクがあります。放射線療法に伴う主な副作用と管理戦略は次の通りです。
急性期
放射線性肺炎(頻度:15-40%):ステロイド治療、抗生剤投与
食道炎(頻度:30-50%):粘膜保護剤、鎮痛剤、栄養サポート
晩期
肺線維症(頻度:5-15%):呼吸リハビリテーション、在宅酸素療法
心臓への影響(頻度:5-10%):心機能モニタリング、適切な心疾患治療
これらの副作用は治療終了後も長期にわたって患者さんのQOLに影響を与える可能性があるために慎重なフォローアップが大切です。
定期的な胸部CT検査や肺機能検査、心エコー検査などによるモニタリングが推奨されます。
免疫チェックポイント阻害薬の特有の副作用
免疫チェックポイント阻害薬は特徴的な免疫関連有害事象(irAE)を引き起こす可能性があります。
| 器官 | 主な irAE | 発現頻度 | 重症度 (CTCAE v5.0) | 主な管理方法 |
| 皮膚 | 発疹、掻痒 | 30-40% | Grade 3-4: 1-2% | ステロイド外用薬、抗ヒスタミン薬 |
| 消化器 | 下痢、大腸炎 | 20-30% | Grade 3-4: 5-10% | ステロイド全身投与、インフリキシマブ |
| 内分泌 | 甲状腺機能異常 | 10-20% | Grade 3-4: 1-2% | 甲状腺ホルモン補充療法 |
irAEの管理において重要なのは早期発見と適切な介入です。推奨されるモニタリング戦略は次の通りです。
- 治療開始前のベースライン評価(甲状腺機能、肝機能、腎機能など)
- 定期的な血液検査と自覚症状の確認
- 患者教育(早期症状の自己認識と報告の重要性)
重度のirAEが発生した場合、免疫チェックポイント阻害薬の一時中断やステロイド治療が必要となることがあります。
治療関連死のリスク
小細胞肺癌の治療は稀ではありますが、治療関連死のリスクを伴います。化学療法による重度の骨髄抑制や、放射線療法による重篤な肺臓炎などが原因となる可能性があります。
治療関連死のリスク因子は以下の通りです。
- 75歳以上の高齢
- 併存疾患の存在
- 全身状態の不良(PS 2以上)
治療関連死のリスクを最小限に抑えるためには以下の対策が重要です。
- 治療開始前の綿密な評価(心肺機能、腎機能、肝機能など)
- リスクに応じた治療強度の調整
- 頻回のモニタリングと早期介入
- 多職種チームによる包括的なケア
長期的な副作用と晩期障害
小細胞肺癌治療後の長期生存者において以下のような晩期障害が問題となることがあります。
- 二次癌のリスク増加(治療後10年で約10-15%)
- 慢性疲労症候群(生存者の30-40%に発症)
- 認知機能障害(特に全脳照射後、20-30%に発症)
- 心肺機能低下(放射線療法後、10-20%に発症)
これらの晩期障害に対しては、以下のような長期的フォローアップ戦略が重要です。
- 定期的な二次癌スクリーニング
- 運動療法や栄養指導による全身状態の維持
- 認知機能リハビリテーション
- 心肺機能の定期的評価と適切な管理
心理社会的影響
治療に伴う副作用やリスクは患者さんに大きな心理的負担をもたらすでしょう。不安やうつ症状、社会的孤立感などが問題となることがあります。
推奨される心理社会的サポートは以下の通りです。
- 定期的な精神状態の評価(うつ病スクリーニングなど)
- 心理カウンセリングの提供
- サポートグループへの参加促進
- 家族を含めた包括的な情報提供とケア
再発リスクと予防策
小細胞肺癌は再発のリスクが高い疾患として知られています。初期治療後も継続的な経過観察と適切な予防策の実施が再発リスクの低減と早期発見に重要な役割を果たします。
患者さんの生活の質(QOL)を維持しながら効果的な再発予防と管理を行うことが長期的な予後改善につながる可能性が高まるでしょう。
再発リスクの評価と影響因子
小細胞肺癌の再発リスクは病期や初期治療への反応性、さらには遺伝子変異の有無などによって異なります。
| 病期 | 2年以内の再発率 | 5年生存率 | 主な再発リスク因子 |
| 限局型 | 60-70% | 20-25% | 腫瘍サイズ、リンパ節転移 |
| 進展型 | 80-90% | 1-2% | 遠隔転移の範囲、治療反応性 |
これらの数値は小細胞肺癌の再発リスクが高いことを示しており、長期的な管理の必要性を強調しているのです。
再発リスクに影響を与える主な因子
- 初期治療への反応性(完全奏効vs部分奏効)
- 腫瘍の遺伝子プロファイル(TP53、RB1遺伝子変異など)
- 患者の全身状態(Performance Status)
- 喫煙歴と禁煙の継続状況
これらの因子を総合的に評価することで、個々の患者さんに適したフォローアップ計画を立てることが大切です。
再発のパターンと好発部位
小細胞肺癌の再発は局所再発と遠隔再発に大別されます。再発部位によって予後や管理方法が異なる場合があります。
再発の主な好発部位と早期発見のポイント
| 再発部位 | 頻度 | 早期発見のための検査 | 自己チェックポイント |
| 肺 | 30-40% | 胸部CT、胸部X線 | 持続する咳、呼吸困難 |
| 脳 | 20-30% | 頭部MRI | 頭痛、めまい、視力変化 |
| 骨 | 15-20% | 骨シンチグラフィ | 持続する骨痛 |
| 肝臓 | 10-15% | 腹部CT、肝機能検査 | 右上腹部痛、黄疸 |
これらの部位を中心に定期的な画像検査や腫瘍マーカーの測定が行われます。患者さん自身による自己チェックも再発の早期発見に役立つでしょう。
再発予防のための包括的戦略
再発リスクを低減するためには包括的なアプローチが大切です。以下のような戦略が考えられます。
- 定期的なフォローアップ
- 禁煙の継続
- 健康的な生活習慣の維持
- 予防的治療の検討
- ストレス管理とメンタルヘルスケア
特に禁煙の継続は再発予防において最も重要な要素です。喫煙は小細胞肺癌の主要なリスク因子であり、再発リスクを高める可能性があるのです。
禁煙支援プログラムへの参加やニコチン代替療法の利用が効果的な場合があります。
健康的な生活習慣の維持として推奨されているのは以下のようなことです。
- バランスの取れた食事(野菜、果物の積極的摂取)
- 適度な運動(週150分以上の中等度有酸素運動)
- 十分な睡眠(1日7-8時間)
- アルコール摂取の制限
これらの生活習慣は全身状態の改善だけでなく、免疫機能の維持にも寄与するでしょう。
予防的治療の選択肢
小細胞肺癌の再発リスクを低減するための予防的治療として以下のような選択肢が考えられます。
| 予防的治療 | 適応 | 期待される効果 | 留意点 |
| 予防的全脳照射 | 限局型、初期治療後CR/PR | 脳転移リスク低減 | 認知機能への影響 |
| 免疫チェックポイント阻害薬維持療法 | 進展型、初期治療後PR以上 | 無増悪生存期間延長 | 免疫関連有害事象 |
| 分子標的薬(臨床試験段階) | 特定の遺伝子変異陽性例 | 再発リスク低減 | 有効性の検証中 |
これらの予防的治療の適応は個々の患者さんの状況や希望を考慮して慎重に検討される必要があります。
QOLを考慮したフォローアップスケジュール
適切なフォローアップは再発の早期発見と予防に不可欠です。一般的なフォローアップスケジュールは以下のようになりますが、患者さんのQOLに配慮した調整が重要です。
| 期間 | 検査頻度 | 主な検査内容 | QOL配慮ポイント |
| 1年目 | 2-3ヶ月毎 | 胸部CT、腫瘍マーカー | 検査の集約化、心理サポート |
| 2-3年目 | 3-6ヶ月毎 | 胸部CT、腫瘍マーカー | 遠隔診療の活用 |
| 4-5年目 | 6-12ヶ月毎 | 胸部CT、腫瘍マーカー | 患者の希望に応じた柔軟な対応 |
フォローアップにおいては単に再発の早期発見だけでなく、患者さんの心理的サポートや社会生活への配慮も大切になってきます。
必要に応じて心理カウンセリングやリハビリテーションなどの支援を組み合わせることで、総合的なQOL維持が図れるでしょう。
再発後の治療選択肢
万が一再発が確認された場合でも様々な治療選択肢が存在します。再発後の治療方針は再発部位、前治療からの期間、患者さんの全身状態などを考慮して決定されるでしょう。
再発後の主な治療選択肢
- 化学療法(二次治療、三次治療)
- 放射線療法(局所再発、脳転移など)
- 免疫チェックポイント阻害薬
- 緩和ケア(症状コントロール中心)
再発後の治療においては腫瘍制御と患者さんのQOL維持のバランスを取ることが特に重要です。
小細胞肺癌の治療費
小細胞肺癌の治療費は診断から治療完了まで高額になることが多く、患者さんとご家族に大きな経済的負担をもたらす可能性があります。
初診料と再診料
初診料は2,910円、再診料は750円です。
検査費用
| 検査名 | 費用(円) |
| 胸部CT | 約14,700円~20,700円 |
| PET-CT | 86,250円 |
治療費用
化学療法の1クール(3週間)あたりの費用は約30万円から50万円程度です。
入院費用
施設によってかなり異なりますが、手術の場合と化学療法+放射線療法の場合の治療+放射線療法の場合入院費用を下記に例として示します。
詳しく述べると、日本の入院費計算方法は、DPC(診断群分類包括評価)システムを使用しています。
DPCシステムは、病名や治療内容に基づいて入院費を計算する方法です。以前の「出来高」方式と異なり、多くの診療行為が1日あたりの定額に含まれます。
主な特徴:
- 約1,400の診断群に分類
- 1日あたりの定額制
- 一部の治療は従来通りの出来高計算
表:DPC計算に含まれる項目と出来高計算項目
| DPC(1日あたりの定額に含まれる項目) | 出来高計算項目 |
| 投薬 | 手術 |
| 注射 | リハビリ |
| 検査 | 特定の処置 |
| 画像診断 | (投薬、検査、画像診断、処置等でも、一部出来高計算されるものがあります。) |
| 入院基本料 | |
計算式は下記の通りです。
「1日あたりの金額」×「入院日数」×「医療機関別係数※」+「出来高計算分」
例えば、14日間入院とした場合は下記の通りとなります。
【手術のみの場合】
DPC名: 肺の悪性腫瘍 肺悪性腫瘍手術 肺葉切除又は1肺葉を超えるもの等 手術処置等2-1あり 定義副傷病名なし
日数: 14
医療機関別係数: 0.0948 (例:神戸大学医学部附属病院)
入院費: ¥373,310 +出来高計算分
+胸腔鏡下肺切除術
1 肺嚢胞手術(楔状部分切除によるもの)398,300円
2 部分切除453,000円
3 区域切除726,000円
4 肺葉切除又は1肺葉を超えるもの810,000円
【化学療法+放射線療法の場合】
DPC名: 肺の悪性腫瘍 その他の手術あり 手術処置等2-3あり
日数: 14
医療機関別係数: 0.0948 (例:神戸大学医学部附属病院)
入院費: ¥408,660 +出来高計算分
保険適用となると1割~3割の自己負担であり、更に高額医療制度の対象となるため、実際の自己負担はもっと安くなります。
なお、上記値段は2024年6月時点のものであり、最新の値段を適宜ご確認ください。
以上
- 参考にした論文