グッドパスチャー症候群とは自己免疫性疾患の一つであり、肺と腎臓に炎症を引き起こす重篤な病気です。
この疾患は体内で抗糸球体基底膜抗体が産生されて肺胞や糸球体の基底膜を攻撃することで発症します。
発症のメカニズムは完全には解明されていませんが、遺伝的な要因や環境因子が関与していると考えられているのです。
主要な症状と特徴
グッドパスチャー症候群の主要な症状は、肺症状と腎症状であり、これらは急速に進行することが特徴です。
肺胞出血や急速進行性糸球体腎炎は生命予後に関わる重篤な症状であり、早期の診断と治療介入が欠かせません。
また、全身症状を伴うこともあり、総合的な症状評価が求められます。
肺症状
グッドパスチャー症候群の初発症状は、しばしば肺症状から始まる傾向です。咳嗽、血痰、呼吸困難などを呈し、急速に進行する肺胞出血を来たすことがあります。
肺胞出血が重篤な場合は呼吸不全に陥ることもあるのです。
| 肺症状 | 頻度 |
| 咳嗽 | 60-80% |
| 血痰 | 50-70% |
| 呼吸困難 | 40-60% |
腎症状
グッドパスチャー症候群では肺症状と同時期または遅れて腎症状が出現します。急速進行性糸球体腎炎を呈して血尿、蛋白尿、浮腫、高血圧などを伴います。
放置すると急速に腎機能が低下して腎不全に至るケースも考えられるのです。
| 腎症状 | 頻度 |
| 血尿 | 80-90% |
| 蛋白尿 | 70-80% |
| 腎機能低下 | 50-70% |
全身症状
グッドパスチャー症候群では肺と腎臓の症状に加えて以下のような非特異的な全身性の症状が出ることもあるでしょう。
- 発熱
- 体重減少
- 倦怠感
- 関節痛
- 筋肉痛
症状の経過
グッドパスチャー症候群の症状は急速に進行することが特徴です。肺胞出血や急速進行性糸球体腎炎は、数日から数週間で重篤な状態に陥ることがあります。
| 症状の経過 | 期間 |
| 発症から診断まで | 数日から数週間 |
| 治療開始から症状改善まで | 数週間から数ヶ月 |
原因と発症のメカニズム
グッドパスチャー症候群の正確な原因は未だ明らかではありませんが、自己免疫異常、遺伝的素因、環境因子などの複合的な要因が関与していると考えられています。
グッドパスチャー症候群の病因解明にはさらなる研究の蓄積が必要です。
自己免疫異常
自己免疫とは本来、外敵から身を守るために機能する免疫システムが自分自身の体組織を攻撃してしまう状態を指します。
グッドパスチャー症候群ではこの自己免疫の異常により肺と腎臓の基底膜が損傷を受けるとされているのです。
| 自己免疫異常 | 機序 |
| 抗GBM抗体の産生 | 肺胞基底膜や糸球体基底膜に対する自己抗体 |
| 免疫複合体の沈着 | 抗原抗体反応による組織障害 |
遺伝的素因
グッドパスチャー症候群の発症には、遺伝的素因が関与していると考えられています。
特定のHLA(ヒト白血球抗原)型との関連が報告されており、これらの遺伝的背景が自己免疫反応の誘発に寄与している可能性があるのです。
しかし遺伝的素因だけでは発症に至らず、環境因子との相互作用が大切であるとされています。
- HLA-DR2
- HLA-DR4
- HLA-DRB1*1501
環境因子
他にもグッドパスチャー症候群の発症に関与が示唆されているのは環境因子です。具体的には喫煙や炭化水素化合物への曝露などがリスク因子として報告されています。
これらの環境因子が肺胞基底膜の損傷を引き起こして自己免疫反応を誘発する可能性が指摘されているのです。
| 環境因子 | リスク |
| 喫煙 | 2-3倍 |
| 炭化水素化合物曝露 | 3-4倍 |
発症メカニズム
グッドパスチャー症候群の発症メカニズムは現段階では以下のように考えられています。
何らかの要因により肺胞基底膜が損傷を受けると通常は隠れている抗原が露出するでしょう。これに対して遺伝的素因や環境因子の影響で産生された抗GBM抗体が反応し、免疫複合体を形成します。
この免疫複合体が肺胞や糸球体の基底膜に沈着することで炎症反応が惹起され、組織障害が引き起こされるという考えです。
- 肺胞基底膜の損傷
- 抗GBM抗体の産生
- 免疫複合体の形成と沈着
- 炎症反応と組織障害
診察と診断における重要な点
グッドパスチャー症候群の診察と診断には多角的なアプローチが必要になります。特に抗GBM抗体の検出と腎生検による免疫蛍光所見は診断に有用です。
詳細な病歴聴取
グッドパスチャー症候群の診察では患者さんの詳細な病歴聴取が欠かせません。
ここでは呼吸器症状や腎症状の出現時期や経過を丁寧に聴取することが大切です。また、喫煙歴や化学物質曝露歴なども確認します。
| 聴取すべき病歴 | 具体的な内容 |
| 呼吸器症状 | 咳嗽、血痰、呼吸困難など |
| 腎症状 | 血尿、蛋白尿、浮腫など |
| 喫煙歴 | 喫煙期間、本数など |
身体所見の確認
全身の身体所見を丁寧に確認することが重要です。特に呼吸器(聴診)、腎臓(浮腫、血圧)、皮膚(紫斑)などに注目します。
さらに、関節症状や神経学的所見の有無も確認するでしょう。
| 確認すべき身体所見 | 具体的な内容 |
| 呼吸器 | 呼吸音、ラ音の有無 |
| 腎臓 | 浮腫、血圧 |
| 皮膚 | 紫斑の有無 |
検査所見の評価
グッドパスチャー症候群の診断には次のような各種検査所見の評価が重要です。
- 血液検査:腎機能、炎症反応、抗GBM抗体
- 尿検査:血尿、蛋白尿、円柱
- 画像検査:胸部X線、胸部CT、腎臓超音波
腎生検と肺生検
グッドパスチャー症候群の確定診断には腎生検も大切になります。
腎生検では糸球体基底膜に沿った線状のIgG沈着を認めることが特徴的です。肺病変が顕著な場合には肺生検も考慮されるでしょう。
生検組織の免疫蛍光染色や電子顕微鏡による評価が診断に有用です。
| 生検 | 特徴的所見 |
| 腎生検 | 糸球体基底膜に沿ったIgG沈着 |
| 肺生検 | 肺胞基底膜に沿ったIgG沈着 |
グッドパスチャー症候群における画像所見の特徴
グッドパスチャー症候群は肺と腎臓に炎症を引き起こす疾患であり、特徴的な画像所見を呈します。
また、病期によって所見が変化するため経時的な評価が大切です。
胸部X線写真の所見
グッドパスチャー症候群の胸部X線写真では肺胞出血を反映して、両側性の浸潤影や斑状影を認めることがあります。時に急速に進行する間質性陰影や濃度上昇を呈することもあるでしょう。
ただし早期の段階では明らかな異常所見を認めないこともあることも考慮してください。
| 胸部X線写真の所見 | 頻度 |
| 両側性浸潤影 | 50-60% |
| 斑状影 | 30-40% |
| 間質性陰影 | 20-30% |
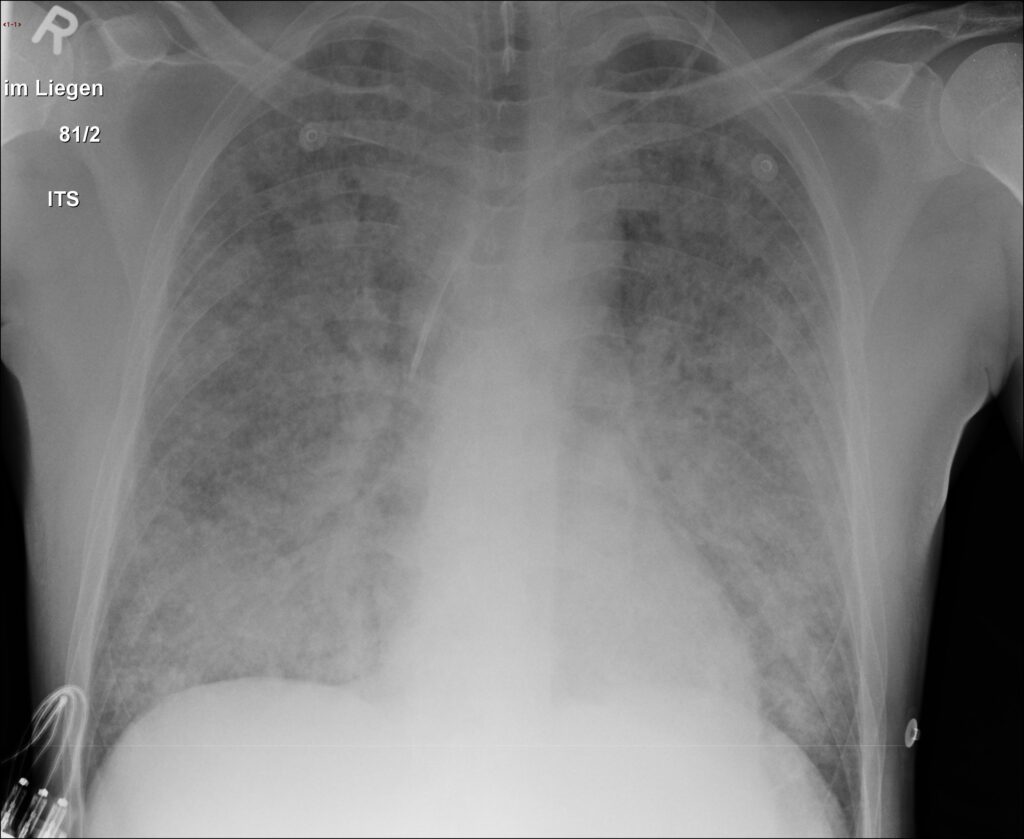
所見:両側肺野びまん性にすりガラス影~浸潤影を認め、びまん性の肺胞出血を反映した所見である。
胸部CTの所見
胸部CTではさらに詳細な肺病変の評価が可能です。グッドパスチャー症候群ではすりガラス影や濃度上昇を伴う斑状影、小葉中心性の結節影などを認めることがあります。
また、気管支壁肥厚や気管支拡張症を伴うケースもみられるでしょう。
| 胸部CTの所見 | 頻度 |
| すりガラス影 | 60-70% |
| 斑状影 | 50-60% |
| 小葉中心性結節影 | 30-40% |
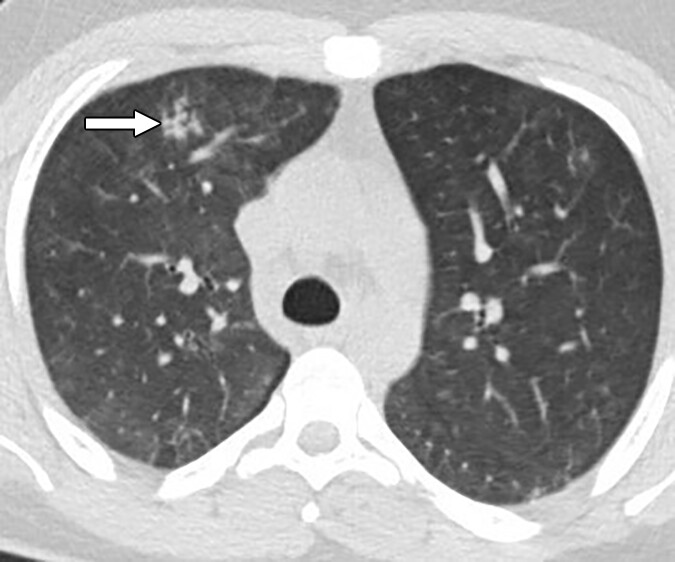
所見:肺胞出血を反映したびまん性で非特異的なすりガラス影が認められ、結合領域(矢印)および両側に複数の淡い小結節が散見される。
腎臓の画像所見
グッドパスチャー症候群では急速進行性糸球体腎炎を呈するため、腎臓の画像所見も重要です。
腹部超音波検査では腎臓の腫大や皮質のエコー輝度上昇を認めることがあり、腎生検組織の免疫蛍光染色では糸球体基底膜に沿ったIgGの線状沈着が特徴的です。
| 腎臓の画像所見 | 頻度 |
| 腎臓腫大 | 50-60% |
| 皮質エコー輝度上昇 | 40-50% |
| 糸球体基底膜IgG沈着 | 80-90% |
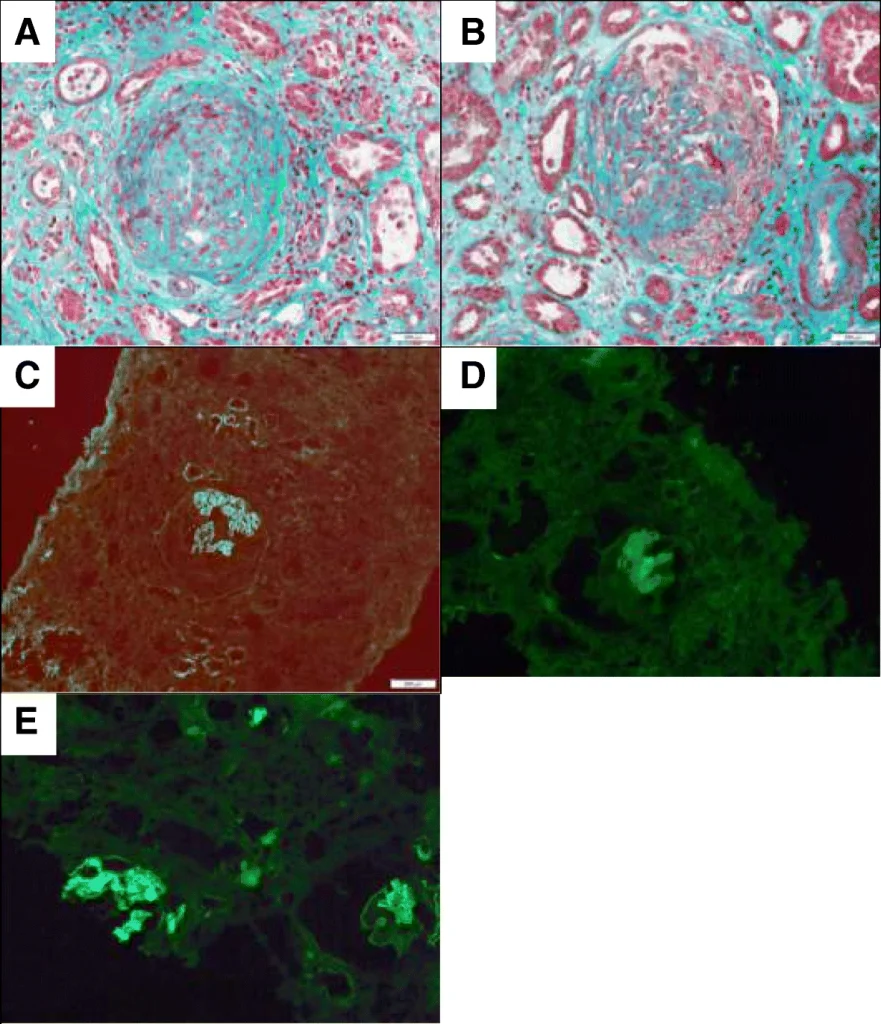
所見:腎生検において、細胞性糸球体半月体形成と糸球体基底膜(GBM)への線状IgG沈着が確認された症例。a:焦点性壊死を伴う線維細胞性糸球体半月体形成。b:半円状の糸球体外毛細血管半月体形成と分節性壊死を伴う糸球体。c:GBM上の免疫グロブリンG(IgG)を検出するための免疫蛍光解析。d:GBM上のIgG1を検出するための免疫蛍光解析。e:GBM上のIgG4を検出するための免疫蛍光解析。
経過中の画像所見の変化
グッドパスチャー症候群の画像所見は病期によって変化します。
急性期には肺胞出血や急速進行性糸球体腎炎を反映した所見が顕著ですが、治療によって改善傾向を示すのです。一方、慢性期には肺の線維化や腎臓の萎縮などの所見を呈することがあります。
定期的な画像検査により、病勢の評価と治療効果の判定を行うことが大切です。
治療法と使用する薬剤、治癒までの期間
グッドパスチャー症候群の治療は病態の制御と臓器障害の予防を目的とした免疫抑制療法が中心となり、重症度に応じて治療強度や期間が決定されます。
治癒までには少なくとも6ヶ月から1年程度の治療継続が必要となりますが、腎機能障害の程度によってはさらに長期の治療が求められます。
初期治療:寛解導入療法
グッドパスチャー症候群と診断された場合、まず高用量のステロイドとシクロホスファミドによる寛解導入療法を行うのが一般的です。
重症例ではステロイドパルス療法を先行することもあります。
| 治療法 | 薬剤と用量 |
| ステロイド | プレドニゾロン 1〜2 mg/kg/日 |
| シクロホスファミド | 2〜3 mg/kg/日 |
| ステロイドパルス療法 | メチルプレドニゾロン 500〜1000 mg/日を3日間 |
血漿交換療法
重症例や抗GBM抗体価が高値の場合には血漿交換療法を併用します。
血漿交換療法は抗GBM抗体を体外に除去することで病勢のコントロールを図るのです。通常1回の交換量を2〜3 L として、連日または隔日で7〜10回程度行います。
寛解維持療法
寛解導入後は再発予防のために免疫抑制剤を継続しながらステロイドを漸減する寛解維持療法を行います。
シクロホスファミドは3〜6ヶ月程度継続し、その後はアザチオプリンやミコフェノール酸モフェチルに切り替えることが多いです。
| 薬剤 | 用量 |
| アザチオプリン | 1〜2 mg/kg/日 |
| ミコフェノール酸モフェチル | 1000〜2000 mg/日 |
治癒までの期間
グッドパスチャー症候群の治療期間は個々の症例によって異なりますが、寛解導入から少なくとも6〜12ヶ月の寛解維持療法が必要とされています。
腎機能障害が高度な場合には、より長期の治療継続が必要となるでしょう。
定期的な経過観察を行い、臨床症状や検査所見をモニタリングしながら治療強度や期間を調整していくことが大切です。
| 治療期間 | 目安 |
| 寛解導入療法 | 2〜4週間 |
| 寛解維持療法 | 6〜12ヶ月 |
| 長期経過観察 | 数年間 |
治療に伴う副作用とリスク
グッドパスチャー症候群の治療には免疫抑制療法が用いられますが、その副作用やリスクについても十分に理解しておく必要があります。
さらに定期的なモニタリングとリスク管理を行うことが大切です。
ステロイドの副作用
グッドパスチャー症候群の治療の中心となるステロイドで考慮すべき副作用は感染症リスクの上昇、高血糖、骨粗鬆症、消化性潰瘍、体重増加、ムーンフェイス、精神症状などです。
| ステロイドの副作用 | リスク管理 |
| 感染症 | 予防接種、衛生管理 |
| 高血糖 | 血糖モニタリング、食事療法 |
| 骨粗鬆症 | ビタミンD・カルシウム補充、骨密度測定 |
シクロホスファミドの副作用
シクロホスファミドは感染症リスクの上昇、骨髄抑制、出血性膀胱炎、不妊などの副作用を引き起こすことがあります。
特に長期使用による二次性白血病のリスクにも注意が必要です。
- 感染症リスクの上昇
- 骨髄抑制
- 出血性膀胱炎
- 不妊
- 二次性白血病
血漿交換療法の合併症
血漿交換療法で報告されている副作用はカテーテル関連感染症、出血、低血圧、アレルギー反応などの合併症です。
大量の血漿交換が原因で凝固因子の低下による出血傾向を来たす可能性も生じるでしょう。
| 血漿交換療法の合併症 | 頻度 |
| カテーテル関連感染症 | 5-10% |
| 出血 | 1-5% |
| 低血圧 | 10-20% |
再発のリスクと予防対策
グッドパスチャー症候群は適切な治療により寛解が得られても、再発のリスクを伴う慢性疾患です。
再発のリスク因子
グッドパスチャー症候群の再発リスクは病型や臓器障害の程度、治療反応性などによって異なります。以下のようなものが再発のリスク因子です。
| リスク因子 | 再発率 |
| 抗GBM抗体高値 | 30-40% |
| 肺胞出血合併 | 20-30% |
| 重度腎機能障害 | 40-50% |
再発予防のための治療戦略
再発予防のためには適切な維持療法と定期的なモニタリングが大切です。
ステロイドの漸減と免疫抑制剤の継続が基本となりますが、再発リスクの高い症例では以下のような治療戦略が考慮されます。
| 治療戦略 | 対象 |
| 長期のステロイド維持療法 | 再発リスクの高い症例 |
| シクロホスファミドの長期使用 | 難治性または再発性の症例 |
| リツキシマブの併用 | 治療抵抗性の症例 |
再発の早期発見と対応
再発の早期発見と迅速な対応が長期予後の改善につながります。定期的な診察と検査により再発の兆候を早期に捉えることが重要です。
再発が疑われる場合にはステロイド増量や免疫抑制剤の再開など、切な治療強化を行います。
| 再発の兆候 | モニタリング方法 |
| 呼吸器症状の再燃 | 胸部X線、CT、呼吸機能検査 |
| 腎機能の悪化 | 血清クレアチニン、尿検査 |
| 抗GBM抗体価の上昇 | 血清抗GBM抗体測定 |
グッドパスチャー症候群の治療にかかる費用
グッドパスチャー症候群の治療費は病状や治療内容によって大きく異なりますが、長期的な治療が必要となるため高額となることも考えておかなければなりません。
初診料と再診料
初診料は2,910円~5,410円程度、再診料は750円~2,660円程度が一般的です。
| 診療内容 | 費用 |
| 初診料 | 2,910円~5,410円 |
| 再診料 | 750円~2,660円 |
検査費
グッドパスチャー症候群の診断や経過観察に必要な検査には血液検査、尿検査、画像検査、腎生検などがあり、それぞれ数千円から数万円の費用がかかります。
| 検査項目 | 費用 |
| 血液検査 | 4,200円(血液一般+生化学5-7項目の場合) +2,620円(抗GBM抗体)+1,440円(免疫学的診断料) |
| 腎生検 | 20,000円(経皮的腎生検法) |
処置費
血漿交換療法の処置は1回につき42,000円/日などの費用が目安です。
入院費
グッドパスチャー症候群の治療では病状に応じて入院治療が必要となることがあります。入院費は1日あたり1万円から3万円程度が一般的です。
詳しく述べると、日本の入院費計算方法は、DPC(診断群分類包括評価)システムを使用しています。
DPCシステムは、病名や治療内容に基づいて入院費を計算する方法です。以前の「出来高」方式と異なり、多くの診療行為が1日あたりの定額に含まれます。
主な特徴:
- 約1,400の診断群に分類
- 1日あたりの定額制
- 一部の治療は従来通りの出来高計算
表:DPC計算に含まれる項目と出来高計算項目
| DPC(1日あたりの定額に含まれる項目) | 出来高計算項目 |
| 投薬 | 手術 |
| 注射 | リハビリ |
| 検査 | 特定の処置 |
| 画像診断 | (投薬、検査、画像診断、処置等でも、一部出来高計算されるものがあります。) |
| 入院基本料 | |
計算式は下記の通りです。
「1日あたりの金額」×「入院日数」×「医療機関別係数※」+「出来高計算分」
例えば、14日間入院とした場合は下記の通りとなります。
DPC名: 重篤な臓器病変を伴う全身性自己免疫疾患 手術処置等2なし 定義副傷病名なし
日数: 14
医療機関別係数: 0.0948 (例:神戸大学医学部附属病院)
入院費: ¥360,570 +出来高計算分
保険適用となると1割~3割の自己負担であり、高額医療制度の対象となるため、実際の自己負担はもっと安くなります。
なお、上記値段は2024年6月時点のものであり、最新の値段を適宜ご確認ください。
以上
- 参考にした論文