呼吸器疾患の一種である好酸球性多発血管炎性肉芽腫症(こうさんきゅうせいたはつけっかんえんせいにくげしゅしょう)とは、気管支喘息や好酸球増多症を伴う全身性血管炎です。
以前は、アレルギー性肉芽腫性血管炎(allergic granulomatous angiitis:AGA)やチャーグ・ストラウス症候群(Churg–Strauss syndrome:CSS)と呼ばれてきた血管炎症候群で、2012年に今の名称に変更がなされました。
主に中小血管に炎症が生じて肺、神経、皮膚など全身のさまざまな臓器に障害をきたします。発症のピークは30〜50歳代で男女比はほぼ同等とされています。
好酸球性多発血管炎性肉芽腫症は比較的まれな疾患ですが、早期発見と速やかな治療開始が重要です。
主要な症状について
好酸球性多発血管炎性肉芽腫症(EGPA)の主要な症状は気管支喘息、アレルギー性鼻炎、末梢神経障害の3つが挙げられます。
気管支喘息
EGPAの患者さんの約90%に気管支喘息が認められ、これは本疾患の特徴的な症状の一つとなっています。
喘息症状は咳、喘鳴、呼吸困難などを呈し、発作性に増悪と寛解を繰り返すことが多いです。
| 症状 | 頻度 |
| 咳 | 80% |
| 喘鳴 | 70% |
| 呼吸困難 | 60% |
アレルギー性鼻炎
アレルギー性鼻炎もEGPAの患者さんに高頻度で認められる症状です。くしゃみ、鼻汁、鼻閉などの典型的なアレルギー性鼻炎症状を呈します。
| 症状 | 頻度 |
| くしゃみ | 75% |
| 鼻汁 | 70% |
| 鼻閉 | 65% |
末梢神経障害
末梢神経障害はEGPAの患者さんの約70%に認められます。手足のしびれ、筋力低下、感覚障害などの症状が特徴的です。
以下のような症状が現れることもあります。
- 手足の痛み
- 手足の脱力感
- 歩行障害
その他の症状
上記の主要な3症状以外にも以下のような全身症状を伴うことがあります。
| 症状 | 頻度 |
| 発熱 | 50% |
| 体重減少 | 40% |
| 関節痛 | 30% |
EGPAが発症する原因と危険因子
好酸球性多発血管炎性肉芽腫症が発症する正確な原因はまだ解明されていませんが、免疫系、感染症、薬剤、環境因子などが複雑に関与しているのではないかと考えられています。
自己免疫疾患との関連
好酸球性多発血管炎性肉芽腫症は体の免疫系が自身の組織を攻撃することで血管炎を引き起こします。
遺伝的素因と環境因子の両方が自己免疫疾患の発症につながるという考えなのです。
| 自己免疫疾患 | 関連する遺伝子 |
| 関節リウマチ | HLA-DR4 |
| 全身性エリテマトーデス | HLA-DR3 |
感染症の関与
ある種のウイルスや細菌感染が好酸球性多発血管炎性肉芽腫症の発症に関与している可能性も示唆されています。
感染症が引き金となって免疫系が過剰に反応し、血管炎を引き起こすのではないかと考えです。
現段階では以下のような感染症との関連が報告されています。
- A型肝炎ウイルス
- B型肝炎ウイルス
- パルボウイルスB19
薬剤の関与
一部の薬剤がEGPAの発症に関与している可能性も指摘されています。これは薬剤によるアレルギー反応 が血管炎を引き起こすのではないかという考えです。
| 薬剤 | 発症リスク |
| 抗甲状腺薬 | 0.2-0.5% |
| 抗てんかん薬 | 0.1-0.3% |
| 抗生物質 | 0.05-0.1% |
環境因子の関与
喫煙やアスベスト曝露などの環境因子もEGPAの発症リスクを高めるのではないかとの報告があります。
特に以下のような環境因子が免疫系に影響を与えることで血管炎を引き起こすのではないかという考えです。
| 環境因子 | 発症リスク |
| 喫煙 | 1.5-2倍 |
| アスベスト曝露 | 2-3倍 |
EGPAの診察と診断の重要性
好酸球性多発血管炎性肉芽腫症の診察と診断には詳細な病歴聴取と身体所見の確認、適切な検査の選択と評価など多角的なアプローチが欠かせません。
患者さんの症状や経過を丁寧に観察し、総合的な判断を下すことが求められる疾患であるのです。
病歴聴取のポイント
診察ではまず患者さんの呼吸器症状や全身症状の経過を丁寧に聴取します。喘息症状の有無や経過、副鼻腔炎の既往、末梢神経障害の症状などを確認することが重要です。
薬剤の使用歴やアレルギー歴についても漏らさず聞き取ります。
| 確認すべき病歴 | 具体的な内容 |
| 呼吸器症状 | 喘息症状の有無と経過 |
| 副鼻腔炎 | 副鼻腔炎の既往 |
| 末梢神経障害 | 手足のしびれや筋力低下 |
身体所見のチェックポイント
全身の観察を行い皮疹や関節症状、神経学的所見などを確認します。
特に四肢の末梢神経障害の有無を丁寧に診察することが大切です。さらに呼吸音の聴診や副鼻腔の診察も欠かせません。
検査の選択と評価
EGPAの診断には血液検査や画像検査、病理検査などが用いられます。
| 検査項目 | 評価ポイント |
| 血液検査 | 好酸球数の増加、炎症反応の上昇、MPO-ANCA陽性 |
| 画像検査 | 胸部X線やCT、副鼻腔CTで肺野や副鼻腔の異常を確認 |
| 病理検査 | 皮膚や神経の生検で血管炎や肉芽腫の有無を評価 |
これらの検査結果を総合的に判断して他の好酸球増多症候群との鑑別を行うことが求められるのです。
EGPAの画像所見の特徴
好酸球性多発血管炎性肉芽腫症の画像所見は多岐にわたり、病変の分布によって特徴的な異なる所見を示します。
画像所見期や治療効果の判定にも有用であり、臨床所見や検査所見と合わせて総合的に判断することが必要です。
胸部X線写真の所見
EGPAの胸部X線写真では多発性の浸潤影や肺野の吸収値の増大、すりガラス影などを認めることがあります。
これらの所見は血管炎による肺胞出血や好酸球浸潤を反映していると言えるのです。時には胸水貯留を伴うこともあるでしょう。
| 胸部X線写真の所見 | 病態との関連 |
| 多発性の浸潤影 | 血管炎による肺胞出血 |
| すりガラス影 | 好酸球浸潤 |
| 胸水貯留 | 血管炎による炎症 |
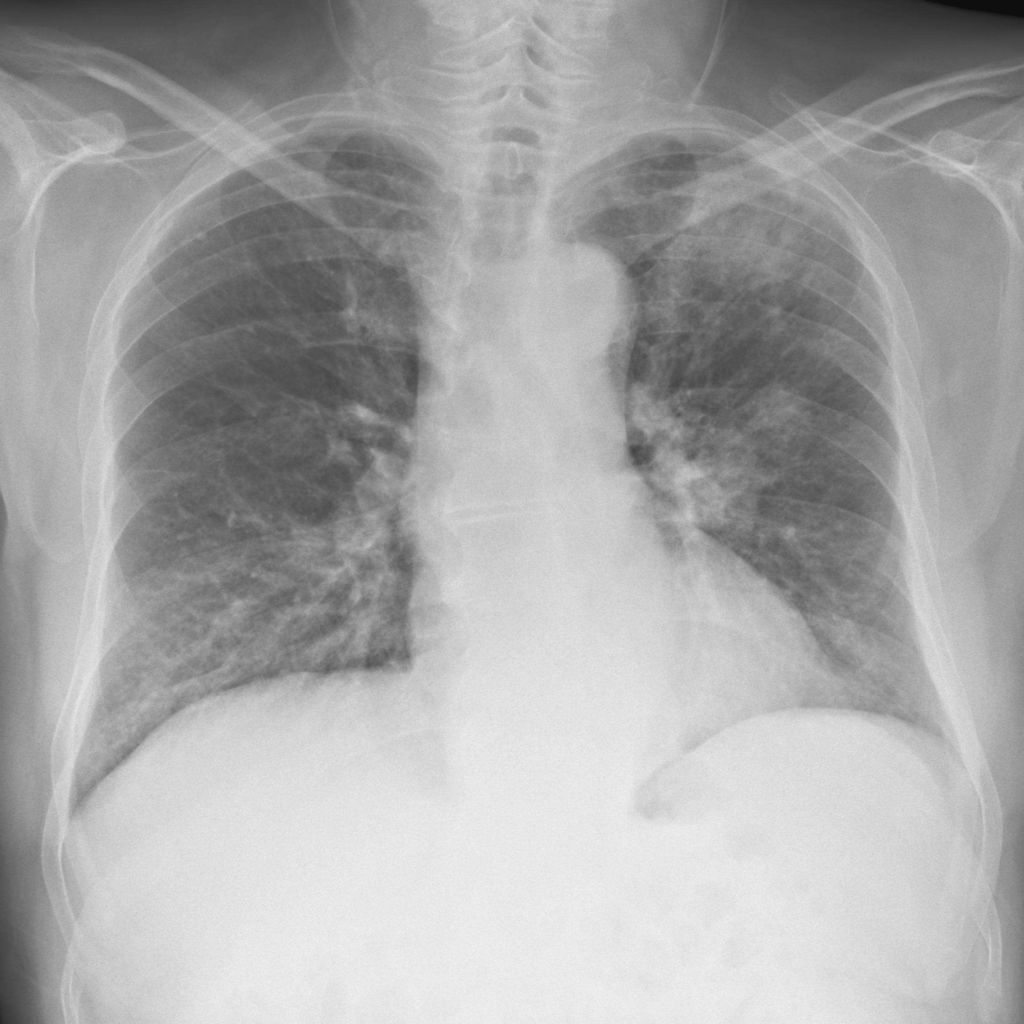
所見:両側全肺野に顕著な間質性線維化や斑状の浸潤影が認められる。
胸部CTの所見
胸部CTでは胸部X線写真では捉えきれない詳細な所見を評価できます。EGPAの所見で認められるのは以下の通りです。
| 胸部CTの所見 | 病態との関連 |
| 多発性の結節影 | 肉芽腫形成 |
| すりガラス影 | 好酸球浸潤 |
| 気管支壁肥厚 | 気管支周囲の炎症 |
これらの所見はEGPAに特徴的ですが、他の疾患でも類似の所見を示す場合があるため臨床所見や検査所見と合わせて総合的に判断する必要があります。
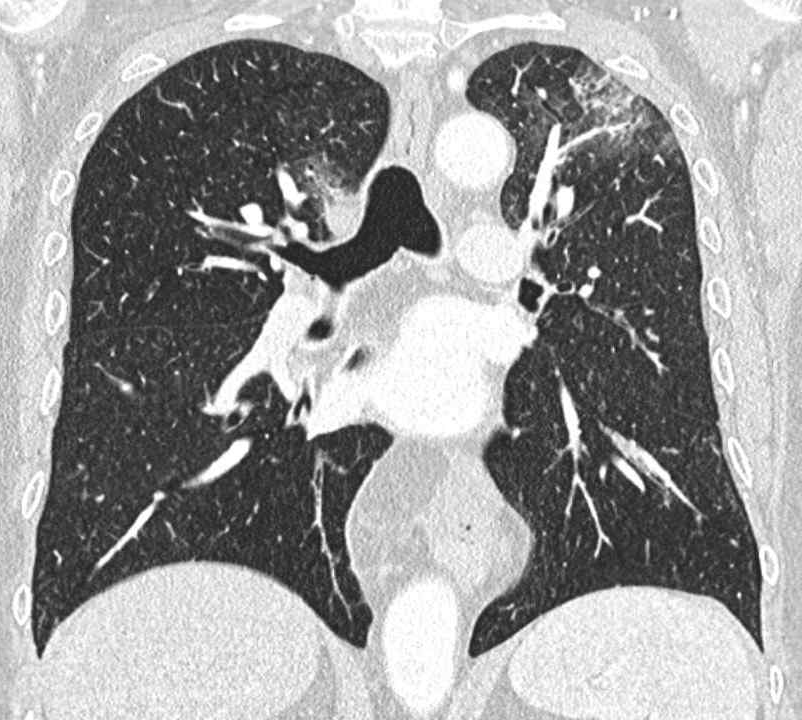
所見:両側上葉に淡いすりガラス影や気管支壁肥厚が認められ、EGPAとして説明可能な所見である。
副鼻腔CTの所見
EGPAでは高率に副鼻腔炎を合併します。副鼻腔CTでは篩骨洞や上顎洞を中心とした粘膜肥厚や陰影を認めることが多いです。時に骨破壊を伴う所見を示すこともあります。
| 副鼻腔CTの所見 | 頻度 |
| 粘膜肥厚 | 高率 |
| 陰影 | 高率 |
| 骨破壊 | まれ |
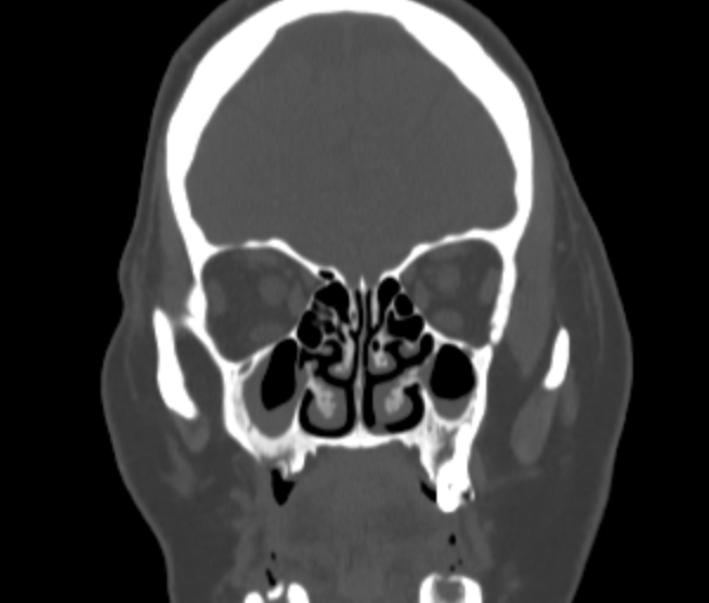
所見:両側上顎洞に液貯留が目立ち、副鼻腔炎と考える。EGPAで高率に併発する所見である。
その他の画像所見
EGPAでは肺や副鼻腔以外にも全身の様々な臓器に病変が生じるのです。例えば末梢神経の肥厚や造影効果を MRI で捉えることができます。
消化管の潰瘍や出血、心筋炎などの所見をそれぞれ適切な画像検査で評価することが重要です。
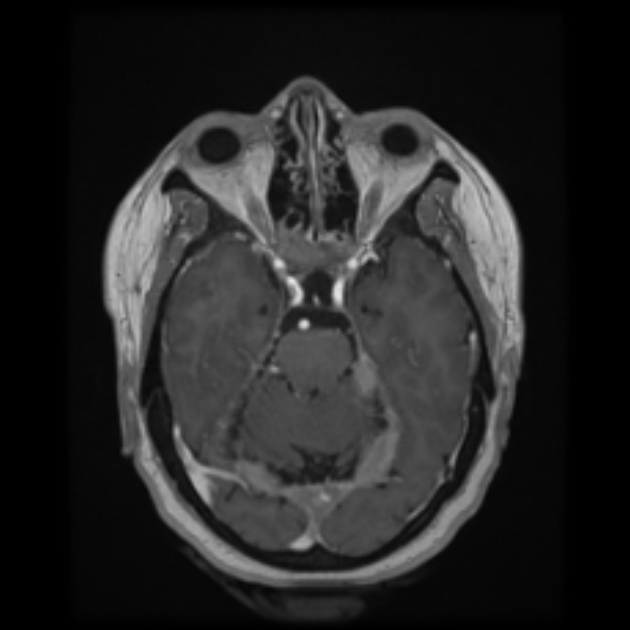
小脳テント中心にGd造影伴う肥厚が目立ち、EGPAの肥厚性髄膜炎として説明可能な所見である。
治療法と薬剤、治癒までの期間
好酸球性多発血管炎性肉芽腫症の治療は病態に応じた免疫抑制療法が中心となり、治療反応性や再発リスクに基づいて治療強度や期間が決定されます。
治癒までには少なくとも1〜2年の治療継続が必要です。
初期治療:寛解導入療法
EGPAと診断された場合、まず高用量のステロイド(プレドニゾロン)による寛解導入療法を行います。
重症例ではステロイドパルス療法(メチルプレドニゾロン)を先行することもあるでしょう。
| 治療法 | 用量 |
| プレドニゾロン | 0.5〜1 mg/kg/日 |
| メチルプレドニゾロン パルス療法 | 500〜1000 mg/日を3日間 |
寛解維持療法
寛解導入後は病勢をみながらステロイドを漸減して再発予防のための寛解維持療法を行います。
以下の免疫抑制剤を併用するケースもありますが、これはステロイド減量中や再発リスクが高い場合です。
| 免疫抑制剤 | 用量 |
| シクロホスファミド | 経口 1〜2 mg/kg/日 or 点滴 500〜750 mg/m2/月 |
| アザチオプリン | 1〜2 mg/kg/日 |
| メトトレキサート | 10〜25 mg/週 |
難治例に対する治療
ステロイドや免疫抑制剤で効果不十分な難治例では生物学的製剤の使用を考慮します。
抗IL-5抗体のメポリズマブは好酸球性炎症を選択的に抑制し、ステロイド減量効果が期待できるでしょう。rituximabやIVIGも選択肢となります。
| 治療法 | 用量 |
| メポリズマブ | 300 mg/4週 皮下注 |
| rituximab | 375 mg/m2/週を4回 or 1000 mg/2週を2回 |
| IVIG | 400 mg/kg/日を5日間 or 1 g/kg/日を2日間 |
治癒までの期間
EGPAの治療期間は個々の症例によって異なりますが、寛解導入から少なくとも12〜18ヶ月の寛解維持療法が推奨されているのです。
再発リスクが高い場合には、より長期の治療継続が必要となることもあります。
定期的なフォローアップを行い臨床症状や検査所見をモニタリングしながら治療強度や期間を調整していくことが大切です。
治療に伴う副作用とリスクについて
好酸球性多発血管炎性肉芽腫症の治療には免疫抑制療法が用いられますが、その副作用やリスクについても十分に理解しておく必要があります。
ステロイドの副作用
EGPAの治療の中心となるステロイドで考慮すべき副作用は感染症リスクの上昇、高血糖、骨粗鬆症、消化性潰瘍、体重増加、ムーンフェイス、精神症状などです。
| ステロイドの副作用 | リスク管理 |
| 感染症 | 予防接種、衛生管理 |
| 高血糖 | 血糖モニタリング、食事療法 |
| 骨粗鬆症 | ビタミンD・カルシウム補充、骨密度測定 |
免疫抑制剤の副作用
シクロホスファミドやアザチオプリンなどの免疫抑制剤は、感染症リスクの上昇、骨髄抑制、肝機能障害、膀胱炎(シクロホスファミド)などの副作用を引き起こすことがあります。
| 免疫抑制剤 | 主な副作用 |
| シクロホスファミド | 骨髄抑制、出血性膀胱炎、不妊 |
| アザチオプリン | 骨髄抑制、肝機能障害、膵炎 |
| メトトレキサート | 骨髄抑制、肝機能障害、間質性肺炎 |
生物学的製剤の副作用
メポリズマブやrituximabなどの生物学的製剤は感染症リスクの上昇、注射部位反応、アレルギー反応などの副作用を引き起こすことがあります。
加えて長期的な安全性についてはまだ十分なデータが蓄積されていないので留意が必要です。
| 生物学的製剤 | 主な副作用 |
| メポリズマブ | 頭痛、注射部位反応 |
| rituximab | インフュージョンリアクション、感染症 |
| IVIG | 頭痛、発熱、アナフィラキシー |
副作用モニタリングとリスク管理
EGPAの治療では定期的な副作用モニタリングとリスク管理が欠かせません。血液検査や尿検査、画像検査などを適宜行って副作用の早期発見に努めることが好まれます。
再発のリスクと予防対策について
好酸球性多発血管炎性肉芽腫症は適切な治療により寛解が得られても再発のリスクを伴う慢性疾患です。
再発リスクは個々の患者さんによって異なりますが、適切な維持療法と定期的なモニタリングにより再発を予防し、長期予後を改善することが可能になります。
再発のリスク因子
EGPAの再発リスクは病型や臓器障害の程度、治療反応性などによって異なります。再発のリスク因子として考えられるのは以下の通りです。
| リスク因子 | 再発率 |
| ANCA陽性 | 40-60% |
| 心血管系の障害 | 30-50% |
| 末梢神経障害 | 20-40% |
再発予防のための治療戦略
再発予防のためには適切な維持療法と定期的なモニタリングが大切です。
ステロイドの漸減と免疫抑制剤の併用が基本となりますが、再発リスクの高い症例では以下のような治療戦略が考慮されます。
| 治療戦略 | 対象 |
| 長期のステロイド維持療法 | 再発リスクの高い症例 |
| 免疫抑制剤の併用 | ステロイド抵抗性または依存性の症例 |
| 生物学的製剤の使用 | 難治性または再発性の症例 |
再発の早期発見と対応
再発の早期発見と迅速な対応が長期予後の改善につながります。定期的な診察と検査によって再発の兆候を早期に捉えることが重要です。
再発が疑われる場合にはステロイド増量や免疫抑制剤の調整など適切な治療強化を行います。
| 再発の兆候 | モニタリング方法 |
| 呼吸器症状の悪化 | 胸部X線、呼吸機能検査 |
| 末梢神経障害の進行 | 神経学的検査、神経伝導検査 |
| 炎症反応の上昇 | 血液検査(好酸球数、CRP、ESRなど) |
治療にかかる費用
EGPAの治療費は病状や治療内容によって大きく異なりますが、長期的な治療が必要で高額となる可能性があるため、経済的な負担は少なくないでしょう。
初診料と再診料
初診料は2,910円~5,410円程度、再診料は750円~2,660円程度が一般的です。
| 診療内容 | 費用 |
| 初診料 | 2,910円~5,410円 |
| 再診料 | 750円~2,660円 |
検査費
EGPAの診断や経過観察に必要な検査には血液検査、画像検査、生検などがあり、それぞれ数千円から数万円の費用がかかります。
| 検査項目 | 費用 |
| 血液検査 | 4,200円(血液一般+生化学5-7項目の場合)+4,950円(pANCA)など |
| CT検査 | 14,700円~20,700円/部位 |
| 生検 | 5,000円(皮膚)~末梢神経(16,200円) |
処置費
ステロイドパルス療法などの処置は、ステロイドパルス(10,296円)+40円/日(プレドニン40mg/日)などの費用がかかるでしょう。
入院費
EGPAの治療では病状に応じて入院治療が必要となることがあります。入院費は1日あたり1万円から3万円程度が一般的です。
詳しく述べると、日本の入院費計算方法は、DPC(診断群分類包括評価)システムを使用しています。
DPCシステムは、病名や治療内容に基づいて入院費を計算する方法です。以前の「出来高」方式と異なり、多くの診療行為が1日あたりの定額に含まれます。
主な特徴:
- 約1,400の診断群に分類
- 1日あたりの定額制
- 一部の治療は従来通りの出来高計算
表:DPC計算に含まれる項目と出来高計算項目
| DPC(1日あたりの定額に含まれる項目) | 出来高計算項目 |
| 投薬 | 手術 |
| 注射 | リハビリ |
| 検査 | 特定の処置 |
| 画像診断 | (投薬、検査、画像診断、処置等でも、一部出来高計算されるものがあります。) |
| 入院基本料 |
計算式は下記の通りです。
「1日あたりの金額」×「入院日数」×「医療機関別係数※」+「出来高計算分」
例えば、14日間入院とした場合は下記の通りとなります。
DPC名: 重篤な臓器病変を伴う全身性自己免疫疾患 手術処置等2なし 定義副傷病名なし
日数: 14
医療機関別係数: 0.0948 (例:神戸大学医学部附属病院)
入院費: ¥360,570 +出来高計算分
保険適用となると1割~3割の自己負担であり、高額医療制度の対象となるため、実際の自己負担はもっと安くなります。
なお、上記値段は2024年6月時点のものであり、最新の値段を適宜ご確認ください。
以上
- 参考にした論文
-
VAGLIO, Augusto; BUZIO, Carlo; ZWERINA, J. Eosinophilic granulomatosis with polyangiitis (C hurg–S trauss): state of the art. Allergy, 2013, 68.3: 261-273.
GIOFFREDI, Andrea, et al. Eosinophilic granulomatosis with polyangiitis: an overview. Frontiers in immunology, 2014, 5: 108976.
FURUTA, Shunsuke; IWAMOTO, Taro; NAKAJIMA, Hiroshi. Update on eosinophilic granulomatosis with polyangiitis. Allergology International, 2019, 68.4: 430-436.
WECHSLER, Michael E., et al. Mepolizumab or placebo for eosinophilic granulomatosis with polyangiitis. New England Journal of Medicine, 2017, 376.20: 1921-1932.
TRIVIOLI, Giorgio; TERRIER, Benjamin; VAGLIO, Augusto. Eosinophilic granulomatosis with polyangiitis: understanding the disease and its management. Rheumatology, 2020, 59.Supplement_3: iii84-iii94.
FAGNI, Filippo; BELLO, Federica; EMMI, Giacomo. Eosinophilic granulomatosis with polyangiitis: dissecting the pathophysiology. Frontiers in Medicine, 2021, 8: 627776.
GROH, Matthieu, et al. Eosinophilic granulomatosis with polyangiitis (Churg–Strauss)(EGPA) Consensus Task Force recommendations for evaluation and management. European journal of internal medicine, 2015, 26.7: 545-553.
EMMI, Giacomo, et al. Evidence-Based Guideline for the diagnosis and management of eosinophilic granulomatosis with polyangiitis. Nature reviews Rheumatology, 2023, 19.6: 378-393.
NGUYEN, Yann; GUILLEVIN, Loïc. Eosinophilic granulomatosis with polyangiitis (Churg–Strauss). In: Seminars in Respiratory and Critical Care Medicine. Thieme Medical Publishers, 2018. p. 471-481.
RAFFRAY, Loïc; GUILLEVIN, Loïc. Treatment of eosinophilic granulomatosis with polyangiitis: a review. Drugs, 2018, 78.8: 809-821.