呼吸器疾患の一種である大細胞肺癌とは肺の中で急速に成長する悪性腫瘍の一つで、その特徴的な細胞構造から名付けられました。
静かに忍び寄る影のように初期段階では目立った症状を示さないことも少なくないため、全肺癌の約10%を占めるこの型は喫煙者に多く見られますが、早期発見が難しいという点が特徴です。
大細胞肺癌(だいさいぼうはいがん)はその名の通り顕微鏡で見ると他の肺癌に比べて大きな細胞から構成されています。
しかしその大きさとは裏腹に癌細胞は非常に攻撃的で急速に増殖し、周囲の組織に浸潤していく性質を持っているのです。
大細胞肺癌の主症状
大細胞肺癌(だいさいぼうはいがん)の主症状は初期段階では無症状であることが多く、進行するにつれて多様な症状が現れます。
これらの症状は腫瘍の大きさ、位置、進行度によって異なり、患者の生活の質に大きな影響を与えることもあるでしょう。
咳
大細胞肺癌の最も一般的な症状の一つが持続する咳です。この咳はまるで肺の奥深くで小さな炎が燃え続けているかのように患者さんを常に悩まるでしょう。
| 咳の特徴 | 頻度 |
| 乾性咳嗽 | 50-60% |
| 湿性咳嗽 | 30-40% |
初期では軽微であっても時間の経過とともに頻度や強度が増すことがあり、睡眠障害や日中の活動制限をもたらす場合があります。
呼吸困難
呼吸困難は大細胞肺癌が進行するにつれて顕著になる症状です。
初期は運動時にのみ感じるのですが、進行が進むにつれてまるで高山の頂上で薄い空気を必死に吸い込むかのような感覚に襲われ、日常的な活動さえも困難になることがあります。
呼吸困難の進行段階
- 軽度:急な階段昇降時のみ
- 中等度:平地歩行時や日常生活動作時
- 重度:安静時でも持続
この症状は腫瘍の増大による肺機能の低下や胸水貯留などの合併症によって引き起こされるのです。
胸痛
胸痛は大細胞肺癌患者の約25-35%で経験される症状です。この痛みは時として胸の内側で電流が走るような鋭さを持つでしょう。
| 痛みの性質 | 特徴 |
| 鈍痛 | 持続的、局所的 |
| 鋭痛 | 間欠的、放散性 |
胸痛は腫瘍が胸膜に浸潤したり肋骨に転移したりすることで生じることがあり、呼吸や体動により増強することもあります。
喀血
喀血は大細胞肺癌患者の約15-20%で見られる症状です。痰に混じる血液の量はほんの僅かな血線から赤いインクを口から吐き出すかのような多量のものまで様々です。
喀血の程度
- 軽度:痰に筋状の血液
- 中等度:鮮血50ml未満/日
- 重度:鮮血50ml以上/日
この症状は腫瘍が気管支血管を侵食することで起こり、患者さんに強い不安と恐怖を与えるとともに緊急の医療介入が必要となる場合があります。
全身症状
大細胞肺癌の進行に伴って全身症状が現れることがあります。主な全身症状は以下の通りです。
| 全身症状 | 頻度 |
| 体重減少 | 50-60% |
| 倦怠感 | 70-80% |
| 発熱 | 20-30% |
また、食欲不振や寝汗もしばしば見られる全身症状です。
これらの症状は腫瘍から放出される物質や体の免疫反応によって引き起こされることがあり、日常生活の質を著しく低下させる可能性もあるでしょう。
神経学的症状
進行した大細胞肺癌では脳転移による神経学的症状が現れることがあります。
神経学的症状の例
| 症状 | 発症頻度 |
| 頭痛 | 30-40% |
| めまい | 20-30% |
| 運動障害 | 15-20% |
| 視力障害 | 10-15% |
このような症状は脳内の転移巣の位置や大きさによって多様な形で現れ、患者さんの日常生活や社会活動に影響を及ぼすでしょう。
発症要因と環境影響
大細胞肺癌の発症には、遺伝的要因、環境因子、生活習慣など複数の要素が複雑に関与しています。
これらの要因が相互に作用し合うことで正常な肺細胞が徐々に癌化し、最終的に大細胞肺癌の発症に至る可能性があるのです。
喫煙
喫煙は大細胞肺癌を含む肺癌全般の最も重要なリスク因子として広く認識されています。
タバコの煙に含まれる多数の発癌物質が肺胞上皮細胞のDNAに直接的な損傷を与え、細胞の遺伝子変異を引き起こすことがあるのです。
| 喫煙状況 | 相対リスク |
| 現在喫煙者 | 15-30倍 |
| 過去喫煙者 | 3-5倍 |
非喫煙者と比較すると喫煙者の大細胞肺癌発症リスクは著しく上昇しますし、喫煙期間や一日の喫煙本数が多いほどそのリスクは高まるのです。
環境因子
以下のような環境中に存在する様々な因子も大細胞肺癌の発症に関与する可能性があります。
- 大気汚染物質(PM2.5、二酸化窒素など)
- ラドン(放射性気体)
- アスベスト
- ディーゼル排気ガス
これらの環境因子は長期間にわたる曝露によって肺組織に慢性的な炎症や遺伝子変異を引き起こすことがあるのです。
| 環境因子 | 推定相対リスク |
| PM2.5高濃度地域 | 1.3-1.5倍 |
| ラドン高濃度地域 | 1.4-1.7倍 |
特に大気汚染が深刻な都市部や地質学的にラドン濃度が高い地域では大細胞肺癌のリスクが上昇する確率が高まります。
遺伝的要因
他にも大細胞肺癌の発症リスクを高める要因として知られているのは、主に次のような特定の遺伝子変異や多型です。
- TP53遺伝子
- RB1遺伝子
- PTEN遺伝子
これらの遺伝子に変異がある場合は細胞の増殖制御や DNA修復機能に異常をきたし、癌化のリスクが高まることがあります。
| 遺伝子変異 | 大細胞肺癌での頻度 |
| TP53変異 | 60-70% |
| RB1変異 | 15-30% |
遺伝的要因は環境因子との相互作用によって大細胞肺癌の発症リスクをさらに高める可能性がでてくるのです。
職業性曝露
特定の職業に従事することで大細胞肺癌の発症リスクが高まる可能性もあります。
職業性リスクが高い職種
- 鉱山労働者(ラドン、シリカ曝露)
- 建設作業員(アスベスト曝露)
- 金属加工業(金属粉じん、クロム化合物曝露)
- 塗装工(有機溶剤曝露)
これらの職業では有害物質への長期的な曝露により、肺組織に慢性的な炎症や遺伝子損傷が蓄積される可能性が高まるのです。
| 職業性曝露 | 推定相対リスク |
| アスベスト高曝露 | 4-6倍 |
| ディーゼル排気ガス | 1.4-1.6倍 |
炎症性肺疾患
大細胞肺癌のリスクを高める可能性がある炎症性肺疾患も認められています。
- 慢性閉塞性肺疾患(COPD)
- 間質性肺炎
- 肺線維症
- 気管支拡張症
これらの疾患では持続的な肺の炎症反応や組織のリモデリングが、遺伝子変異の蓄積や細胞の異常増殖を促進させてしまうことがあるのです。
ウイルス感染
次のような特定のウイルス感染も大細胞肺癌の発症リスクを高める可能性が示唆されています。
- ヒトパピローマウイルス(HPV)
- エプスタイン・バーウイルス(EBV)
これらのウイルスは細胞の遺伝子発現を変化させて癌化のプロセスを促進する可能性が生じるのです。
リスク因子の存在が必ずしも発症に直結するわけではありませんが、上記の要因を理解して可能な範囲でリスク低減に努めることが望ましいでしょう。
診察と診断方法
大細胞肺癌の診察と診断プロセスは多様な検査法を組み合わせることで高い精度と信頼性を実現しています。
問診
問診は大細胞肺癌の診断プロセスにおいて極めて重要な第一歩です。
ここでは症状の経過、持続期間、生活環境、職業歴、喫煙歴などの詳細な情報を収集します。
| 問診項目 | 着目点 |
| 喫煙歴 | 本数/年、禁煙期間 |
| 職業歴 | 有害物質への曝露 |
| 家族歴 | 肺癌の既往 |
これらの情報は大細胞肺癌のリスク評価や他の肺癌との鑑別に不可欠な要素です。
身体診察
身体診察では大細胞肺癌の存在や進行度を示唆する重要な手がかりとなることがあるため、以下のポイントに注意して全身状態と局所症状を評価します。
- 視診:チアノーゼ、ばち状指の有無
- 聴診:呼吸音の異常(局所的な減弱や雑音)
- 打診:局所的な濁音の有無
- 触診:リンパ節腫脹の確認
画像診断
画像診断は大細胞肺癌の検出と評価において中心的な役割を果たします。
| 検査法 | 特徴 | 検出感度 |
| 胸部X線 | スクリーニング | 60-70% |
| 胸部CT | 詳細な病変評価 | 90-95% |
| PET-CT | 代謝活性評価 | 85-90% |
特に低線量CTによる肺がん検診は早期発見率が向上しますし、PET-CTは腫瘍の代謝活性を評価するため遠隔転移の検索に有用です。
これらの画像検査を組み合わせることで腫瘍の位置、大きさ、進展度を正確に把握することが可能となります。
気管支鏡検査
気管支鏡検査は気管支内腔を直接観察して異常所見を確認しながら病変部位から組織を採取するので、大細胞肺癌の確定診断において重要な役割を果たします。
気管支鏡検査の主な手法は以下の通りです。
- 経気管支肺生検(TBLB)
- 気管支擦過細胞診
- 気管支洗浄細胞診
近年では超音波気管支鏡(EBUS)を用いることで、より精密な病変の同定と組織採取が可能です。
病理診断
病理診断は採取した腫瘍組織を病理医が観察して組織学的特徴を評価するため、大細胞肺癌の確定診断と詳細な分類において不可欠です。
| 病理所見 | 意義 | 頻度 |
| 大型細胞 | 診断の基本 | 100% |
| 核小体明瞭 | 悪性度の指標 | 90-95% |
| 多形性 | 分化度の評価 | 70-80% |
さらに、免疫組織化学染色を用いることで腫瘍細胞の起源や特性をより詳細に把握することが可能になります。
分子生物学的検査
分子生物学的検査は大細胞肺癌の特性をより深く理解して個別化された治療方針を決定する上で重要です。
主な検査対象遺伝子は次の通りです。
- KRAS遺伝子変異
- ALK融合遺伝子
- ROS1融合遺伝子
これらの遺伝子異常の有無は分子標的薬の適応を決定する上で重要な情報となります。
| 遺伝子変異 | 頻度 | 臨床的意義 |
| KRAS変異 | 20-30% | 予後不良因子 |
| ALK融合遺伝子 | 5-10% | ALK阻害剤の適応 |
さらに、次世代シーケンサーを用いた包括的遺伝子解析は、より詳細な遺伝子プロファイルの把握が可能となります。
液体生検
液体生検は血液中の循環腫瘍細胞(CTC)や循環腫瘍DNA(ctDNA)を検出する非侵襲的な診断方法です。
この手法は繰り返し検査が可能であり、腫瘍の経時的な変化をモニタリングする上で有用です。
液体生検の利点
- 非侵襲的な検査
- 腫瘍の不均一性の評価
- 治療効果のリアルタイムモニタリング
大細胞肺癌の画像所見
大細胞肺癌の画像所見はその多様性と特徴的なパターンによって診断に重要な役割を果たします。
胸部X線、CT、PET-CTなどの画像検査を組み合わせることで腫瘍の存在、位置、大きさ、進展度を詳細に評価て適切な治療方針の決定に寄与することが可能となります。
胸部X線所見
胸部X線検査は大細胞肺癌のスクリーニングや初期評価において基本となる画像検査です。
典型的な胸部X線所見として、孤立性肺結節影や周囲組織への浸潤を示唆する不整な陰影が観察されることがあります。
| 所見 | 特徴 | 頻度 |
| 孤立性肺結節 | 辺縁不整、大きさ>3cm | 60-70% |
| 浸潤影 | 周囲組織との境界不明瞭 | 30-40% |
これらの所見は特に肺野末梢に出現することが多く、早期発見の手がかりとなることがあるのです。
しかしながら胸部X線では小さな病変や淡い陰影を検出することが困難な場合もあり、その限界を認識することが重要です。
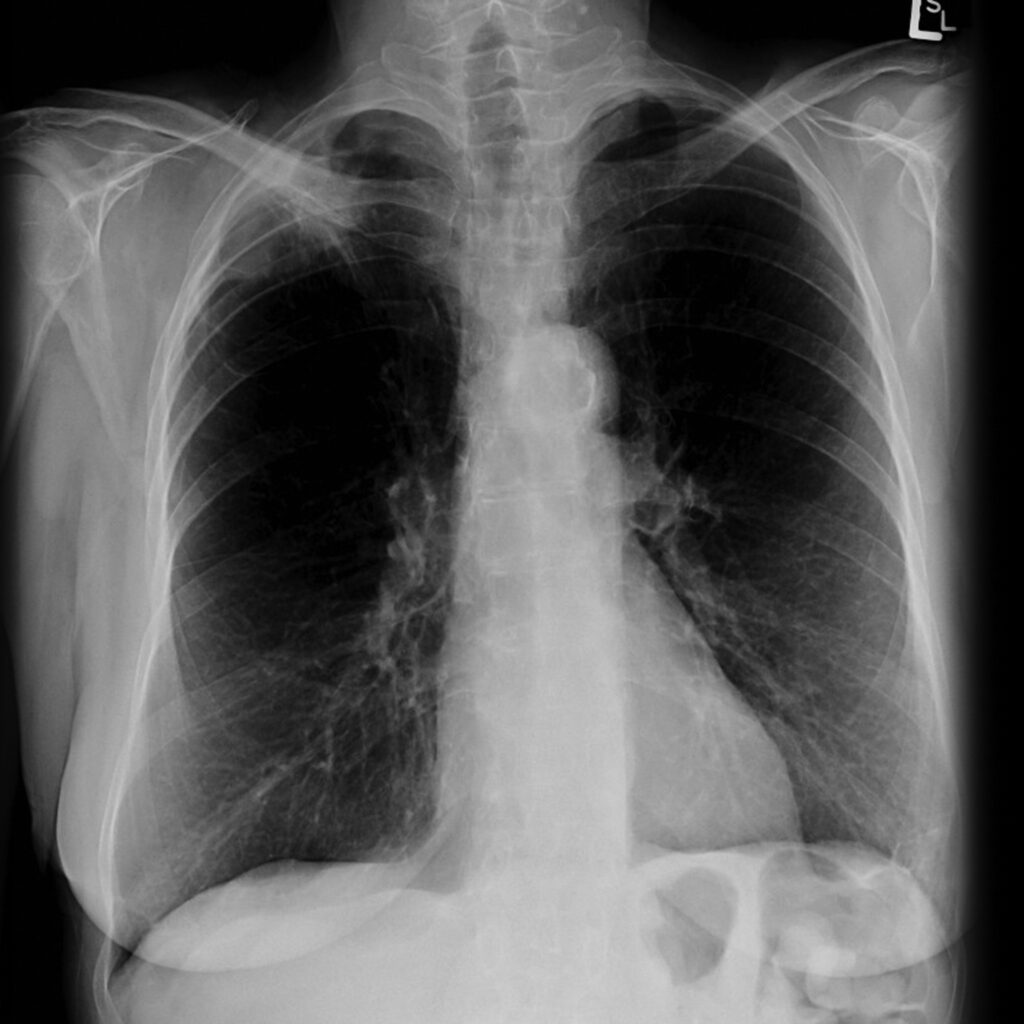
所見:右肺尖部にspicula伴う結節影を認める。
CT所見
CT検査、特に高分解能CT(HRCT)は以下のような特徴的な所見が観察大細胞肺癌の診断において中心的な役割を果たします。
- 大型の充実性結節影
- 不整な辺縁
- 胸膜陥入像
- 血管・気管支の収束像
これらの所見は腫瘍の悪性度や進行度を反映していることがあるのです。
| CT所見 | 特徴 | 診断的意義 |
| 大型結節 | 直径>3cm | 悪性示唆 |
| スピキュラ | 放射状の線状影 | 浸潤性を示唆 |
| 胸膜陥入 | V字型の陥凹 | 悪性を示唆 |
充実成分の割合が高く、辺縁が不整であるほど悪性度が高くなる傾向があることが報告されています。
造影CT所見
造影CTは腫瘍の血流評価と内部構造の詳細な解析に有用です。大細胞肺癌の造影パターンは次の通りです。
- 不均一な造影増強
- 壊死や嚢胞形成を示す低吸収域
- 周囲組織への浸潤を示す造影効果
| 造影パターン | 特徴 | 頻度 |
| 不均一増強 | 内部に低吸収域 | 70-80% |
| リング状増強 | 辺縁優位の増強 | 20-30% |
これらの造影パターンは腫瘍の内部構造や周囲組織への浸潤度を評価する上で重要な情報を提供します。
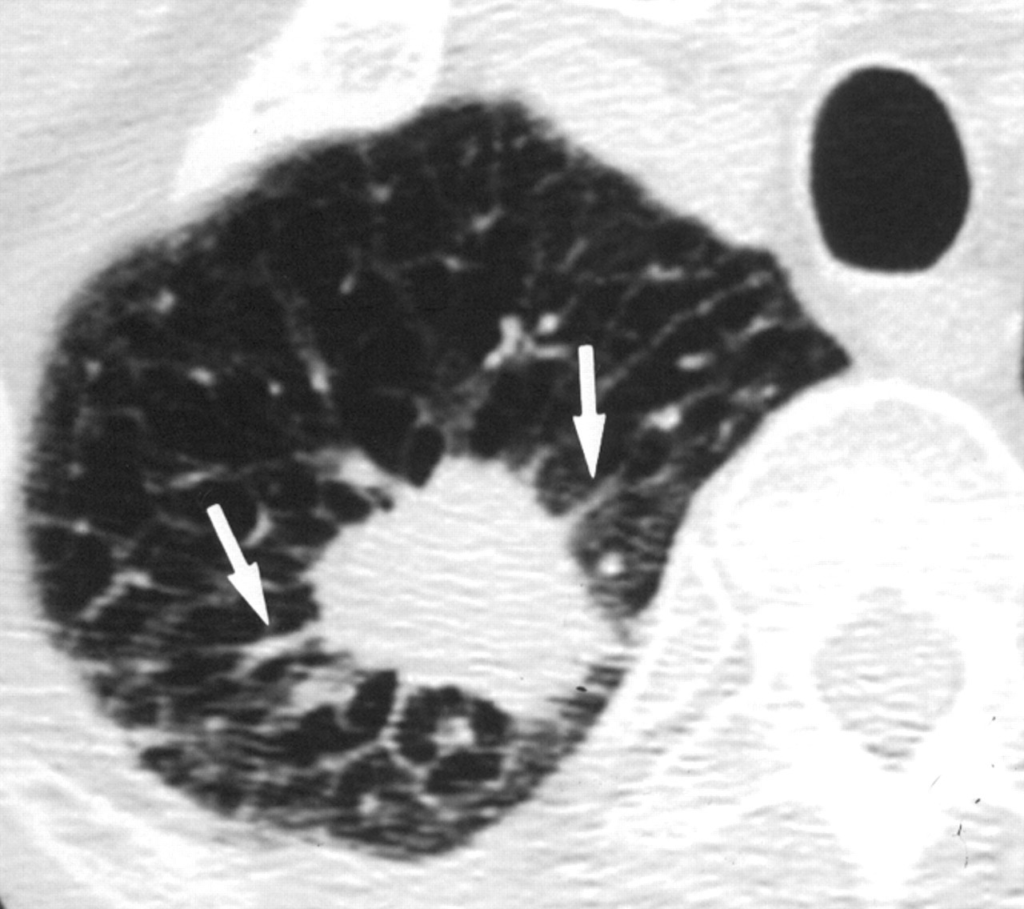
所見:71歳男性の大細胞神経内分泌癌の症例。右肺には気腫性変化・bullaあり。右肺尖部にspicula・胸膜嵌入伴う結節を認める。
PET-CT所見
PET-CT検査は大細胞肺癌の代謝活性を評価し、病期診断や転移検索に有用な情報を提供します。
FDG(フルオロデオキシグルコース)を用いたPET-CTでは、大細胞肺癌は通常高いSUV(Standardized Uptake Value)を示すことがあります。
PET-CTの特徴的所見:
- 原発巣の高度FDG集積
- リンパ節転移の検出
- 遠隔転移の評価
| PET-CT所見 | SUV値 | 臨床的意義 |
| 高FDG集積 | >5.0 | 悪性度高 |
| 中等度集積 | 2.5-5.0 | 悪性疑い |
SUV値が高いほど腫瘍の悪性度や予後不良因子となる可能性が高いことが報告されています。
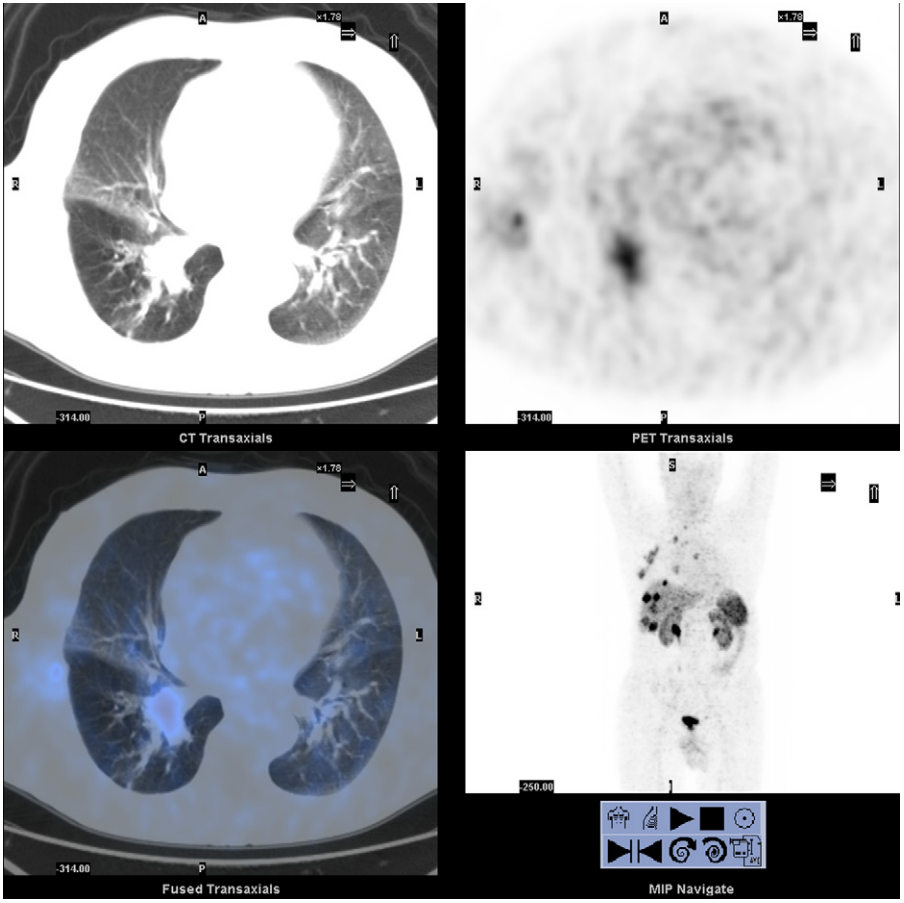
所見:68Ga-DOTANOC PET/CTでは、原発性肺神経内分泌腫瘍(NET)を有する患者において、複数の肺、胸膜、リンパ節、および肝臓病変が見られ、ソマトスタチン受容体の高発現が示されている。
MRI所見
MRI検査による特徴的所見は大細胞肺癌の軟部組織浸潤や胸壁浸潤の評価に有用です。
- T1強調像:低〜中等度信号
- T2強調像:不均一な高信号
- 拡散強調像:高信号(拡散制限)
| MRI撮像法 | 所見 | 診断的意義 |
| T1強調像 | 低信号 | 腫瘍実質 |
| T2強調像 | 高信号 | 浮腫・壊死 |
MRIは特に胸壁浸潤や縦隔浸潤の評価においてCTを補完する役割を果たすことがあります。
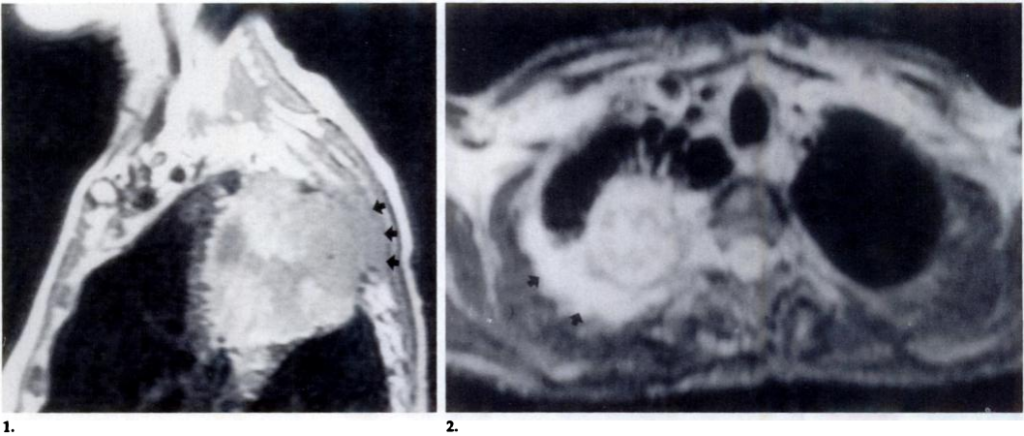
所見:(1)T1強調像では、右上葉に腫瘤を認める。壁内の腫瘍信号(矢印)が明らかであり、少なくとも1つの後肋弓が軟部組織侵襲により消失している。(2)別患者。T2強調像では、右上葉に椎骨および後壁に接する腫瘤を認める。壁内の腫瘍より連続した高信号域(矢印)は、胸壁浸潤を示している。
治療戦略と回復への道のり
大細胞肺癌の治療は病期、遺伝子変異の有無、患者の全身状態などを考慮して個別化されます。複数の治療法を適切に組み合わせて治療効果の最大化と生活の質の維持を目指します。
治癒までの期間は個々の症例により大きく異なりますが、早期発見・早期治療が重要です。
手術療法
早期の大細胞肺癌では手術による完全切除が治癒を目指す上で重要な選択肢となります。
手術方法には肺葉切除術や区域切除術などがあり、腫瘍の位置や大きさ、患者の肺機能に応じて適切な術式が選択されることがあるでしょう。
| 手術方法 | 適応 | 5年生存率 |
| 肺葉切除術 | 標準的手術 | 40-50% |
| 区域切除術 | 小型腫瘍 | 30-40% |
手術後の経過観察期間は通常5年間とされ、この期間無再発で経過すれば治癒と判断されることがあります。
局所制御と機能温存
放射線療法は手術不能例や手術拒否例に対する根治的治療として、また手術後の補助療法としても用いられます。
放射線療法の種類と目的
- 根治的放射線療法:局所進行癌に対する単独治療
- 定位放射線療法:早期大細胞肺癌に対する低侵襲治療
- 術後補助放射線療法:再発リスク低減
放射線療法による局所制御率は早期癌で70-80%、局所進行癌で40-50%程度です。
薬物療法
進行期の大細胞肺癌や術後再発例では以下のような薬物療法が治療の中心となることがあります。
| 薬剤の種類 | 代表的薬剤 | 奏効率 |
| 細胞障害性抗癌剤 | シスプラチン+エトポシド | 40-50% |
| 免疫チェックポイント阻害剤 | ペムブロリズマブ | 30-40% |
| 血管新生阻害剤 | ベバシズマブ | 20-30% |
このような薬物療法は単独または併用で使用され、患者の状態や遺伝子変異の有無に応じて選択されます。
免疫療法
ニボルマブ、ペムブロリズマブ、アテゾリズマブといった免疫チェックポイント阻害剤は進行期大細胞肺癌の治療に効果的です。
これらの薬剤はPD-L1発現率などのバイオマーカーに基づいて使用されることがあります。
この免疫療法はおよそ2年間に渡り2-3週間おきに投与が必要で、根気がいる治療法です。
分子標的療法
大細胞肺癌の一部では特定の遺伝子変異が見つかることがあり、これらの症例では次のような分子標的薬が有効な場合があります。
- ALK阻害剤(アレクチニブ、クリゾチニブなど)
- ROS1阻害剤(クリゾチニブなど)
- BRAF阻害剤(ダブラフェニブ+トラメチニブ)
| 遺伝子変異 | 頻度 | 推奨される分子標的薬 |
| ALK融合遺伝子 | 2-5% | アレクチニブ |
| ROS1融合遺伝子 | 1-2% | クリゾチニブ |
これらの分子標的薬は、該当する遺伝子変異を持つ患者さんで高い効果を得られるでしょう。
集学的治療
大細胞肺癌の治療では、しばしば下記のように複数の治療法を組み合わせた集学的治療が行われます。
- 術前化学療法→手術→術後放射線療法
- 化学放射線療法→免疫療法
- 手術→術後化学療法→分子標的療法
これらの複合的アプローチにより、単一の治療法では得られない相乗効果が期待できる可能性が広がるのです。
治療効果の評価と経過観察
治療効果は腫瘍マーカー、画像検査、全身状態から定期的に評価され、必要に応じて治療の継続や変更が検討されます。
以下は評価項目の一例です。
| 評価時期 | 主な評価項目 |
| 治療開始3ヶ月後 | CT、腫瘍マーカー |
| 6ヶ月後 | CT、PET-CT、PS |
大細胞肺癌の治療期間と治癒までの道のりは病期や治療反応性によって大きく異なり、早期癌では手術後5年間無再発であれば治癒と判断されるでしょう。
一方、進行期癌では完全な治癒は困難な場合もありますが、適切な治療により長期生存や良好な生活の質の維持が期待できることがあります。
免疫療法や分子標的療法の導入によって進行期大細胞肺癌の予後は改善傾向にあり、5年生存率は15-25%程度まで向上しているのです。
副作用とリスク
大細胞肺癌の治療はその効果と引き換えに様々な副作用やリスクを伴う可能性があります。これらの副作用は治療の種類や患者の個別性によって異なり、時に重篤な合併症を引き起こすことがあります。
手術療法に関連する合併症
手術療法は肺組織の一部を切除するため、呼吸機能の低下や術後合併症のリスクを考慮しなければなりません。
手術後に生じる可能性のある主な問題点
- 呼吸困難感の増強
- 慢性的な痛み
- 術後感染症
| 合併症 | 発生頻度 | 影響 |
| 呼吸不全 | 10-15% | 日常生活に支障 |
| 肺炎 | 5-10% | 入院期間延長 |
| 創部感染 | 2-5% | 治癒遅延 |
これらの副作用は患者さんの年齢や全身状態、手術の範囲によって発生リスクが異なるケースが多いです。
放射線療法に伴う急性と晩期有害事象
放射線療法では照射部位周辺の正常組織にも影響を与える可能性があり、急性期と晩期の有害事象が生じることがあります。
急性期有害事象(治療中〜治療後数週間)
| 有害事象 | 発生頻度 | 持続期間 |
| 肺臓炎 | 15-40% | 数週間〜数ヶ月 |
| 食道炎 | 30-50% | 2-4週間 |
| 皮膚炎 | 40-60% | 1-2週間 |
晩期有害事象(治療後数ヶ月〜数年)には肺線維症や心膜炎などがあり、長期的なフォローアップが必要となることも考えておかなければなりません。
細胞障害性抗癌剤による全身性の副作用
細胞障害性抗癌剤はがん細胞だけでなく正常細胞にも影響を与えるため、様々な全身性の副作用が生じる可リスクがあります。
主な副作用とその特徴は以下の通りです。
| 副作用 | 発生頻度 | 特徴 | 対処法 |
| 骨髄抑制 | 80-90% | 感染リスクの上昇、貧血、出血傾向 | 薬剤調整、支持療法 |
| 消化器症状 | 60-80% | 悪心・嘔吐、食欲不振、下痢 | 制吐剤、栄養管理 |
| 脱毛 | 70-90% | 外見の変化による精神的ストレス | ウィッグ、帽子の使用 |
使用する薬剤の種類や投与量、患者さん自身の体質によってこれらの副作用の重症度は異なります。
免疫チェックポイント阻害剤の免疫関連リスク
免疫チェックポイント阻害剤は免疫系を活性化させることで、免疫関連有害事象を引き起こす可能性が生じるのです。
次のような疾患が代表的な免疫関連有害事象です。
| 有害事象 | 発生頻度 | 発症時期 |
| 間質性肺炎 | 5-10% | 投与後数週〜数ヶ月 |
| 甲状腺機能異常 | 10-20% | 投与後1-2ヶ月 |
| 大腸炎 | 2-5% | 投与後1-3ヶ月 |
これらの有害事象は従来の抗がん剤とは異なる発症メカニズムを持つので、適切な管理と早期対応が大切になってきます。
分子標的薬の副作用
分子標的薬は特定の分子を標的とするため、従来の抗癌剤とは異なる以下のような副作用プロファイルを持つことがあります。
| 分子標的薬 | 主な副作用 | 発生頻度 |
| ALK阻害剤 | 肝機能障害、間質性肺疾患、視覚障害 | 20-30% |
| ROS1阻害剤 | 末梢性浮腫、末梢性浮腫、QT間隔延長 | 15-25% |
これらの副作用は薬剤の継続使用に影響を与える可能性もあるため適切な管理が不可欠です。
治療関連二次癌のリスク
大細胞肺癌の治療後、特に放射線療法や特定の化学療法を受けた患者さんでは治療関連二次癌のリスクが上昇することがあります。
二次癌のリスク因子としては高線量放射線療法の既往やアルキル化剤の使用歴、若年での治療開始などが挙げられるでしょう。
| 治療法 | 二次癌リスク | 好発部位 |
| 放射線療法 | 1.5-2倍 | 食道、乳房 |
| 化学療法 | 1.3-1.8倍 | 白血病、膀胱癌 |
これらのリスクを考慮して大細胞肺癌の治療には長期的なフォローアップと定期的なスクリーニングが重要です。
再発リスクと効果的な予防戦略
適切な管理と生活習慣の改善を行うことで大細胞肺癌の再発リスクは低減できる可能性は十分にあります。再発予防には毎日の生活で気を付けるべきことをコツコツと続けることが大切です。
再発リスクの評価と特徴
大細胞肺癌の再発リスクに影響を与える主な要因には次のようなものがあります。
- 初期治療時の病期
- 腫瘍の完全切除の有無
- 特定の遺伝子変異(TP53, RB1など)の存在
| 病期 | 5年再発率 | リスク因子 |
| I期 | 30-40% | 腫瘍径, 脈管侵襲 |
| II期 | 50-60% | リンパ節転移 |
| III期 | 70-80% | 遺残腫瘍 |
これらのリスク因子を適切に評価し、個別化された再発予防戦略を立てることが必要です。
定期的なフォローアップ
再発を早期に発見して適切な対応を行うためには計画的なフォローアップが不可欠です。
フォローアップにおける主な検査項目
- 胸部CT検査
- 腫瘍マーカー(NSE, ProGRPなど)
- PET-CT検査(必要に応じて)
| フォローアップ時期 | 推奨検査 | 頻度 |
| 術後1-2年 | 胸部CT, 腫瘍マーカー | 3-4ヶ月毎 |
| 術後3-5年 | 胸部CT, 腫瘍マーカー | 6ヶ月毎 |
| 術後5年以降 | 胸部CT | 年1回 |
これらの定期的な評価により再発の兆候を早期に捉えることが可能となります。
生活習慣の改善による再発予防
日常生活における習慣の改善は再発予防に大切です。
再発予防のための生活習慣改善策
- 禁煙の徹底
- 適度な有酸素運動(週150分以上)
- バランスの取れた食事(野菜・果物の摂取増加)
- ストレス管理(瞑想、ヨガなど)
| 生活習慣 | 再発リスク低減効果 | 推奨される実践方法 |
| 禁煙 | 30-50% | 禁煙外来の利用, ニコチン代替療法 |
| 運動 | 20-30% | ウォーキング, 水泳, サイクリング |
これらの生活習慣改善は再発予防だけでなく、全身の健康維持にも非常に役立つでしょう。
免疫機能の強化と感染予防
免疫機能の維持・強化も再発予防において重要な要素です。手洗いうがいの徹底、人混みでのマスク着用、肺炎球菌やインフルエンザの予防接種などの日々の感染予防はどなたでもできます。
また、7-8時間程度の十分な睡眠、ビタミンDやプロバイオティクスの摂取といった免疫機能強化対策は再発の予防としても推奨されています。
| 免疫強化策 | 期待される効果 | 実践方法 |
| 睡眠改善 | NK細胞活性化 | 就寝時間の規則化, 睡眠環境の整備 |
| ビタミンD | T細胞機能向上 | 日光浴, サプリメント摂取(医師相談の上) |
ストレス管理と心理的サポート
慢性的なストレスは免疫機能の低下を招き、結果的に再発リスクを高めてしまうでしょう。以下のようなストレス管理も重要です。
- リラクセーション技法(深呼吸法, 筋弛緩法)
- 認知行動療法
- サポートグループへの参加
| ストレス管理法 | 効果 | 実践頻度 |
| 瞑想 | コルチゾール低下 | 毎日15-30分 |
| 認知行動療法 | 不安・抑うつ軽減 | 週1回, 8-12週間 |
環境因子への配慮
環境因子も大細胞肺癌の再発リスクに影響を与える可能性があります。
注意すべき環境因子
- 大気汚染(PM2.5, 二酸化窒素など)
- 職業性曝露(アスベスト, ラドンなど)
- 受動喫煙
| 環境因子 | リスク低減策 | 効果 |
| 大気汚染 | 空気清浄機使用 | PM2.5 50-70%除去 |
| 職業性曝露 | 適切な防護具使用 | 曝露量80-90%低減 |
これらの環境因子への曝露を最小限に抑えることで、再発リスクを低減できる可能性が高まるでしょう。
治療費用・入院費用
施設によってかなり異なりますが、手術の場合と化学療法+放射線療法の場合の治療+放射線療法の場合入院費用を下記に例として示します。
詳しく述べると、日本の入院費計算方法は、DPC(診断群分類包括評価)システムを使用しています。
DPCシステムは、病名や治療内容に基づいて入院費を計算する方法です。以前の「出来高」方式と異なり、多くの診療行為が1日あたりの定額に含まれます。
主な特徴:
- 約1,400の診断群に分類
- 1日あたりの定額制
- 一部の治療は従来通りの出来高計算
表:DPC計算に含まれる項目と出来高計算項目
| DPC(1日あたりの定額に含まれる項目) | 出来高計算項目 |
| 投薬 | 手術 |
| 注射 | リハビリ |
| 検査 | 特定の処置 |
| 画像診断 | (投薬、検査、画像診断、処置等でも、一部出来高計算されるものがあります。) |
| 入院基本料 | |
計算式は下記の通りです。
「1日あたりの金額」×「入院日数」×「医療機関別係数※」+「出来高計算分」
例えば、14日間入院とした場合は下記の通りとなります。
【手術のみの場合】
DPC名: 肺の悪性腫瘍 肺悪性腫瘍手術 肺葉切除又は1肺葉を超えるもの等 手術処置等2-1あり 定義副傷病名なし
日数: 14
医療機関別係数: 0.0948 (例:神戸大学医学部附属病院)
入院費: ¥373,310 +出来高計算分
+胸腔鏡下肺切除術
1 肺嚢胞手術(楔状部分切除によるもの)398,300円
2 部分切除453,000円
3 区域切除726,000円
4 肺葉切除又は1肺葉を超えるもの810,000円
【化学療法+放射線療法の場合】
DPC名: 肺の悪性腫瘍 その他の手術あり 手術処置等2-3あり
日数: 14
医療機関別係数: 0.0948 (例:神戸大学医学部附属病院)
入院費: ¥408,660 +出来高計算分
保険適用となると1割~3割の自己負担であり、更に高額医療制度の対象となるため、実際の自己負担はもっと安くなります。
なお、上記値段は2024年6月時点のものであり、最新の値段を適宜ご確認ください。
長期管理費用
年間の総治療費は外来管理で約50-70万円、入院を要する場合は150万円以上になることもあるのです
経済的支援
がん治療の就労支援制度や民間の医療保険の活用も検討する価値があります。
以上
- 参考にした論文