代謝疾患の一種であるポルフィリン症とは、体内でヘムという重要な物質を作る過程に問題が生じる遺伝性の病気です。
ヘムは赤血球中のヘモグロビンの主要な構成要素であり、酸素を運ぶ役割を担っています。
ポルフィリン症ではヘムの合成に関わる酵素の異常により、ポルフィリンという中間生成物が体内に蓄積します。
この蓄積が様々な症状を引き起こして患者さんの生活に影響を与える可能性があるのです。
ポルフィリン症には複数の病型があり、それぞれ異なる酵素の異常によって引き起こされます。
ポルフィリン症の病型について
ポルフィリン症はヘム合成経路の酵素異常によって引き起こされる代謝疾患群であり、その病型は複数存在します。
これらの病型は主に急性型と皮膚型に大別されますが、一部の病型では両方の特徴を併せ持つことがあります。
各病型は異なる酵素の欠損や機能低下によって特徴づけられ、それぞれ固有の臨床像を呈します。
ポルフィリン症の正確な診断と適切な管理のためにはこれらの病型を理解することが重要です。
急性型ポルフィリン症
急性型ポルフィリン症には以下の4つの病型が含まれます。
- 急性間欠性ポルフィリン症(AIP)
- 遺伝性コプロポルフィリン症(HCP)
- 異型ポルフィリン症(VP)
- ALA脱水酵素欠損ポルフィリン症(ADP)
これらの病型は主に次のような神経系統の症状が特徴です。
| 病型 | 欠損酵素 |
| AIP | ポルホビリノーゲン脱アミナーゼ |
| HCP | コプロポルフィリノーゲン酸化酵素 |
| VP | プロトポルフィリノーゲン酸化酵素 |
| ADP | δ-アミノレブリン酸脱水酵素 |
急性間欠性ポルフィリン症(AIP)は急性型ポルフィリン症の中で最も一般的な病型です。
遺伝性コプロポルフィリン症(HCP)と異型ポルフィリン症(VP)は急性症状に加えて皮膚症状を呈することがあります。
ALA脱水酵素欠損ポルフィリン症(ADP)は非常に稀な病型であり、重度の神経症状が特徴です。
皮膚型ポルフィリン症
皮膚型ポルフィリン症には主に以下の4つの病型が含まれます。
- 晩発性皮膚型ポルフィリン症(PCT)
- 肝性骨髄性ポルフィリン症(HEP)
- 先天性骨髄性ポルフィリン症(CEP)
- 骨髄性プロトポルフィリン症(EPP)
これらの病型は主に光線過敏性の皮膚症状が特徴です。
| 病型 | 主な特徴 |
| PCT | 後天性が多い |
| HEP | 非常に稀 |
| CEP | 重度の光線過敏症 |
| EPP | 小児期発症が多い |
晩発性皮膚型ポルフィリン症(PCT)は、皮膚型ポルフィリン症の中で最も一般的な病型です。
肝性骨髄性ポルフィリン症(HEP)は、非常に稀な病型であり、肝臓と骨髄の両方に影響を与えます。
先天性骨髄性ポルフィリン症(CEP)は、生後早期から重度の光線過敏症を呈する重篤な病型です。
骨髄性プロトポルフィリン症(EPP)は、小児期から発症することが多く、慢性的な光線過敏症を特徴とします。
複合型ポルフィリン症
一部のポルフィリン症は急性症状と皮膚症状の両方を呈することがあり、これらを複合型ポルフィリン症と呼ぶことがあります。
主な複合型ポルフィリン症は以下の通りです。
- 異型ポルフィリン症(VP)
- 遺伝性コプロポルフィリン症(HCP)
| 病型 | 急性症状 | 皮膚症状 |
| VP | あり | あり |
| HCP | あり | あり |
これらの病型では患者さんによって症状の現れ方が異なることがあります。
病型の遺伝形式
ポルフィリン症の多くは遺伝性疾患であり、その遺伝形式は病型によって異なります。
- 常染色体優性遺伝
- AIP
- VP
- HCP
- EPP(一部)
- 常染色体劣性遺伝
- ADP
- CEP
- HEP
- EPP(一部)
晩発性皮膚型ポルフィリン症(PCT)は遺伝性と非遺伝性(獲得性)の両方の形態が存在します。

ポルフィリン症の主症状
ポルフィリン症はヘム合成経路の酵素異常により引き起こされる代謝疾患群です。
この疾患の主症状は病型によって大きく異なりますが、主に神経症状、皮膚症状、消化器症状に分類されます。
症状の発現は環境因子や遺伝的要因によって影響を受けることがあり、個人差が顕著です。
8つの主要な病型ごとに特徴的な症状を詳しく解説していきます。
急性型ポルフィリン症の症状
急性間欠性ポルフィリン症(AIP)、遺伝性コプロポルフィリン症(HCP)、異型ポルフィリン症(VP)、ALA脱水酵素欠損ポルフィリン症(ADP)の4つは急性型ポルフィリン症に分類されます。
これらの病型に共通する主要な症状は激しい腹痛です。
腹痛は周期的に現れることが多く、その強さは患者さんを苦しめる最も深刻な症状の一つとなります。
| 症状 | 特徴 |
| 腹痛 | 激しく、周期的 |
| 嘔吐 | 持続的で難治性 |
| 便秘 | 重度の場合あり |
| 頻脈 | 自律神経症状 |
急性型ポルフィリン症では神経系の症状も顕著です。
末梢神経障害による筋力低下や感覚異常、中枢神経系の障害による意識障害や痙攣などが現れることがあります。
これらの神経症状は時に生命を脅かすほど重篤化する可能性があるため、早期発見と適切な対応が極めて必要不可欠です。
皮膚型ポルフィリン症の症状
晩発性皮膚型ポルフィリン症(PCT)、肝性骨髄性ポルフィリン症(HEP)、先天性骨髄性ポルフィリン症(CEP)、骨髄性プロトポルフィリン症(EPP)は主に皮膚症状を特徴とする病型です。
これらの病型では光線過敏症が主要な症状となります。
| 皮膚症状 | 発症部位 |
| 水疱 | 露光部 |
| 色素沈着 | 顔面、手背 |
| 瘢痕化 | 繰り返し露光部 |
| 脆弱化 | 全身 |
光線過敏症の程度は病型によって異なり、EPPでは数分の日光暴露でも激しい痛みや灼熱感を感じることがあります。
一方、PCTでは比較的長時間の日光暴露後に水疱や色素沈着が現れやすいという点が特徴です。
CEPは最も重度の皮膚症状を呈し、幼少期から顔面や手指の変形を伴う重篤な症状が現れることがあります。
その他の症状と合併症
ポルフィリン症では主要な症状以外にも様々な症状や合併症が報告されています。
以下はその代表的なものです。
- 精神症状(不安、抑うつ、幻覚など)
- 内分泌異常(甲状腺機能低下症など)
- 肝機能障害
- 腎機能障害
上記の症状は病型や個人によって発現の仕方が異なり、時に診断を難しくする要因となります。
| 合併症 | 関連する病型 |
| 肝細胞癌 | PCT |
| 溶血性貧血 | CEP、EPP |
| 胆石症 | EPP |
| 骨粗鬆症 | 複数の病型 |
症状管理の重要性
ポルフィリン症の症状管理においては早期発見と適切な対応が極めて重要です。
急性発作の予防や皮膚症状の軽減のために以下のような点に注意を払う必要があります。
- 誘発因子の回避(特定の薬物、アルコール、ストレスなど)
- 日光暴露の管理(皮膚型ポルフィリン症)
- 定期的な健康チェック
- 栄養バランスの維持
症状の種類や重症度は病型によって大きく異なるため、個々の患者さんに合わせたきめ細かな対応が必要です。
ポルフィリン症の症状は複雑で多岐にわたりますが、適切な管理によって多くの患者さんが良好な生活の質を維持できることを強調しておきます。

原因と発症メカニズム
ポルフィリン症の遺伝的背景
ポルフィリン症はヘム合成経路における酵素の遺伝子変異が主な原因となる代謝疾患群です。
この疾患は常染色体優性遺伝または常染色体劣性遺伝のパターンをとり、家族性に発症することが多いのが特徴です。
遺伝子変異によってヘム合成に関わる酵素の機能が低下または欠損し、その結果としてポルフィリンやその前駆体が体内に蓄積することで発症します。
各病型に関連する遺伝子変異は以下の通りです。
| 病型 | 関連遺伝子 |
| 急性間欠性ポルフィリン症(AIP) | HMBS |
| 遺伝性コプロポルフィリン症(HCP) | CPOX |
| 異型ポルフィリン症(VP) | PPOX |
| ALA脱水酵素欠損ポルフィリン症(ADP) | ALAD |
| 晩発性皮膚型ポルフィリン症(PCT) | UROD |
| 肝性骨髄性ポルフィリン症(HEP) | UROD |
| 先天性骨髄性ポルフィリン症(CEP) | UROS |
| 骨髄性プロトポルフィリン症(EPP) | FECH |
これらの遺伝子変異はヘム合成経路の異なる段階で酵素機能に影響を与えるため、各病型で特有の代謝異常が生じます。
環境因子と発症のトリガー
遺伝的素因を持つ個人であっても必ずしも症状が現れるわけではありません。
多くの場合に特定の環境因子が発症のトリガーとなります。
主な環境因子は以下の通りです。
- 薬物(バルビツール酸系薬剤、スルホンアミド系抗生物質など)
- ホルモン変動(月経周期、妊娠など)
- アルコール摂取
- 喫煙
- ストレス
- 感染症
- 栄養不足(特に低炭水化物食)
これらの因子はヘム合成経路に負荷をかけたりポルフィリンの代謝や排泄に影響を与えたりすることで、症状の発現や悪化を引き起こす可能性があります。
病型別の発症メカニズム
各病型によって発症のメカニズムや原因となる酵素異常が異なります。ここでは代表的な病型について詳しく見ていきます。
急性間欠性ポルフィリン症(AIP)はHMBS遺伝子の変異によりヒドロキシメチルビラン合成酵素の機能が低下することで発症します。
この酵素異常によってポルフィリン前駆体のALAとPBGが蓄積し、神経系に悪影響を及ぼすのです。
| AIP発症の要因 | 影響 |
| HMBS遺伝子変異 | 酵素機能低下 |
| ALA・PBG蓄積 | 神経毒性 |
| 環境因子 | 症状誘発 |
晩発性皮膚型ポルフィリン症(PCT)はUROD遺伝子の変異または後天的な酵素阻害によって引き起こされます。
この病型では肝臓におけるウロポルフィリノーゲン脱炭酸酵素の活性低下が中心的な役割を果たします。
PCTの発症には遺伝的要因に加えて複数の環境因子が関与することが多い点が特徴です。
ヘム合成経路の異常と代謝産物の蓄積
ポルフィリン症の本質的な原因はヘム合成経路における代謝異常にあります。
この経路の各段階で働く酵素の機能不全によりって中間代謝産物であるポルフィリンやその前駆体が過剰に産生され、体内に蓄積するのです。
蓄積する代謝産物の種類や量は病型によって異なります。
| 病型 | 主な蓄積物質 |
| 急性間欠性ポルフィリン症 | ALA, PBG |
| 遺伝性コプロポルフィリン症 | コプロポルフィリン |
| 異型ポルフィリン症 | プロトポルフィリン |
| 晩発性皮膚型ポルフィリン症 | ウロポルフィリン |
これらの代謝産物の蓄積は組織や臓器に様々な影響を与え、それぞれの病型に特徴的な臨床像を形成するのです。
例えばALAとPBGの蓄積は神経系への影響が強く、急性型ポルフィリン症の神経症状の原因となります。
一方、ポルフィリンの蓄積は皮膚の光線過敏症を引き起こすことが知られています。
遺伝的多様性と発症リスク
ポルフィリン症の遺伝的背景は非常に複雑で、同じ遺伝子変異を持っていても発症の有無や重症度には個人差があります。
この現象は遺伝的浸透度の不完全性と呼ばれ、ポルフィリン症の遺伝的特徴の一つです。
遺伝的浸透度に影響を与える要因として以下のものが挙げられます。
- 遺伝子変異の種類と位置
- 他の遺伝子との相互作用
- エピジェネティックな修飾
これらの要因が複雑に絡み合うことで同じ家系内でも発症パターンに違いが生じることがあるのです。
ポルフィリン症の原因とメカニズムの解明は個別化医療の観点からも重要な課題です。

診察と診断
ポルフィリン症診断の基本アプローチ
ポルフィリン症の診断はその多様な臨床像と稀少性ゆえに困難を伴うことがあります。
しかし詳細な問診と適切な検査の組み合わせによって正確な診断に至ることが可能です。
診断の第一歩は患者さんの症状や家族歴、生活習慣などについて綿密に聴取することから始まります。
特に急性発作の有無や皮膚症状の特徴、発症のきっかけとなった可能性のある因子などに注目して情報を収集します。
問診で得られた情報を基に疑われる病型を絞り込み、それに応じた検査を選択することが診断の精度を高める上で極めて重要です。
生化学的検査によるスクリーニング
ポルフィリン症の診断において生化学的検査は中心的な役割を果たします。
尿中、便中、血中のポルフィリンおよびその前駆体の定量が主な検査項目です。
| 検査項目 | 主な対象病型 |
| 尿中ALA・PBG | AIP, HCP, VP |
| 尿中ポルフィリン | PCT, CEP |
| 便中ポルフィリン | VP, HCP |
| 血中プロトポルフィリン | EPP |
急性型ポルフィリン症が疑われる際には尿中ALA(δ-アミノレブリン酸)とPBG(ポルフォビリノーゲン)の定量が特に有用です。
これらの値が顕著に上昇している場合では急性ポルフィリン症の可能性が高まります。
一方、皮膚型ポルフィリン症では尿中や便中のポルフィリン分画分析が診断の鍵です。例えばPCTでは尿中ウロポルフィリンの増加が特徴的です。
これらの生化学的検査はポルフィリン症の診断において不可欠な要素であり、病型の鑑別にも有用な情報をもたらします。
遺伝子検査による確定診断
生化学的検査でポルフィリン症が強く疑われた後、遺伝子検査による確定診断が行われることがあります。
各病型に対応する遺伝子の変異を同定することで、より確実な診断が可能となるのです。
| 病型 | 検査対象遺伝子 |
| 急性間欠性ポルフィリン症 | HMBS |
| 遺伝性コプロポルフィリン症 | CPOX |
| 異型ポルフィリン症 | PPOX |
| 晩発性皮膚型ポルフィリン症 | UROD |
遺伝子検査は以下のような場合に特に有用です。
- 生化学的検査で結果が曖昧な場合
- 家族内スクリーニングが必要な場合
- 遺伝カウンセリングを行う際
ただし遺伝子検査の実施に関しては倫理的配慮や患者さんの意思を尊重することが重要になります。
検査前後の適切な遺伝カウンセリングを通じて患者さんや家族に十分な情報提供と心理的サポートを行うことが求められます。
病型別の診断アプローチ
各病型によって診断のアプローチや重視すべき検査項目が異なります。ここでは代表的な病型について具体的な診断手順を解説します。
急性間欠性ポルフィリン症(AIP)の診断では急性腹症などの典型的な臨床症状に加え、尿中ALAとPBGの著明な上昇が診断の決め手となります。
発作時の尿は赤褐色を呈することがあり、これはワトソン・シュワルツ試験で簡易的に確認できるのです。
晩発性皮膚型ポルフィリン症(PCT)の診断は特徴的な皮膚症状と尿中ウロポルフィリンの増加、さらに肝機能検査や鉄代謝関連検査を組み合わせて行います。
骨髄性プロトポルフィリン症(EPP)では幼少期からの重度の光線過敏症の既往と血中遊離プロトポルフィリンの顕著な上昇が診断の鍵です。
鑑別診断の重要性
ポルフィリン症の症状は他の疾患と類似することがあるため、適切な鑑別診断が求められます。
特に急性腹症を呈する場合には以下のような疾患との鑑別が必要です。
- 急性虫垂炎
- 胆石症
- 膵炎
- 腸閉塞
また、皮膚症状については以下の疾患との鑑別が重要になります。
- 日光アレルギー
- 薬疹
- 自己免疫性水疱症
鑑別診断を行う上では詳細な病歴聴取と適切な検査の選択が大切です。
特にポルフィリン症に特異的な検査結果(尿中ポルフィリン前駆体の上昇など)が得られた際は本疾患を積極的に疑う必要があります。

多様な画像所見
ポルフィリン症の画像診断概要
ポルフィリン症の画像所見は病型によって大きく異なり、時に非特異的な変化を示すことがあります。
しかしながら適切な画像検査を選択して詳細に観察することで、診断や経過観察に有用な情報を得ることができます。
画像検査は臨床症状や生化学的検査結果と合わせて総合的に解釈することが極めて重要です。
ポルフィリン症の画像診断では主に以下の検査法が用いられます。
- X線検査
- CT(コンピュータ断層撮影)
- MRI(磁気共鳴画像法)
- 超音波検査
- 蛍光診断
これらの検査を適切に組み合わせることで、各病型に特徴的な所見を捉えることが可能となります。
急性型ポルフィリン症の画像所見
急性間欠性ポルフィリン症、遺伝性コプロポルフィリン症、異型ポルフィリン症、ALA脱水酵素欠損ポルフィリン症などの急性型ポルフィリン症では主に腹部症状に関連する画像所見が重要です。
| 検査法 | 主な所見 |
| 腹部CT | 腸管拡張、腸管壁肥厚 |
| 腹部MRI | 腸管浮腫、腹水 |
| 腹部超音波 | 胆嚢壁肥厚、肝腫大 |
急性型ポルフィリン症の腹部CTではしばしば非特異的な腸管拡張や腸管壁の肥厚が観察されます。
これらの所見は急性腹症の鑑別診断において重要な手がかりとなります。
MRIではT2強調画像で腸管壁の浮腫性変化や軽度の腹水貯留が認められることがあります。
また、急性期には肝臓のびまん性腫大や胆嚢壁の肥厚が超音波検査で観察されることもあるでしょう。
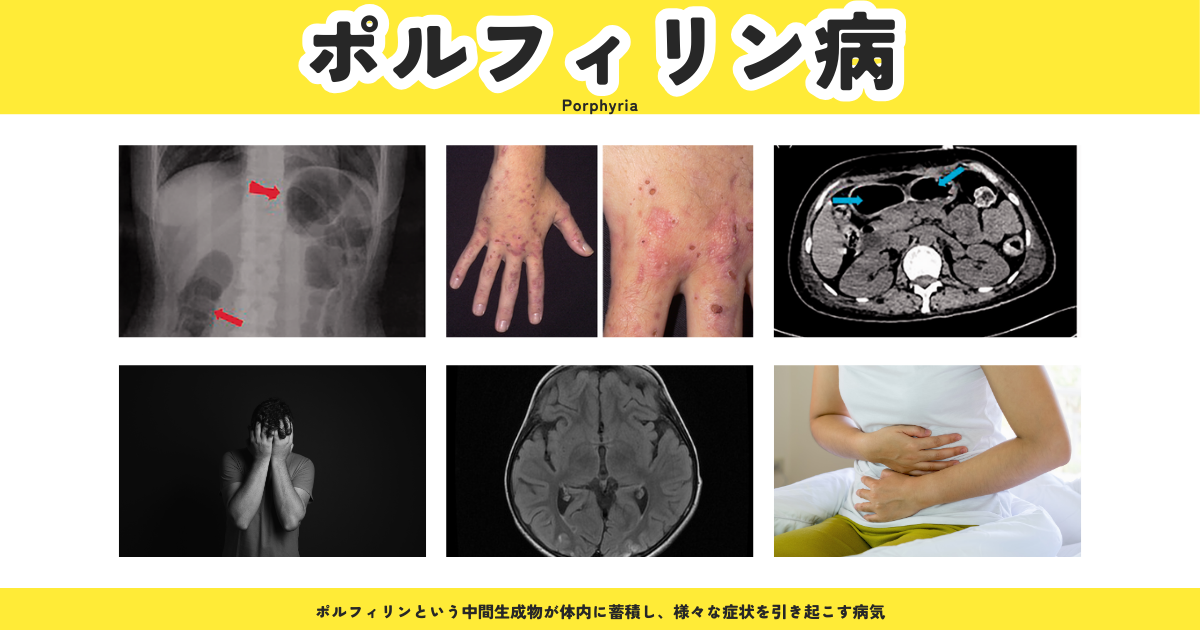
所見:急性間欠性ポルフィリン症の患者。(a) 外科病棟に最初に来院した際の腹部X線は、不完全な腸閉塞を示しており、赤い矢印で示される明らかな胃腸ガスが見られる。(b) 集中治療室に移送された際の腹部CTでは、明らかな病変は認められなかった。(c) 集中治療室に移送されて14日後の腹部CTでは、非特異的な腸閉塞を示しており、青い矢印で示される広範な結腸の拡張が認められる。
皮膚型ポルフィリン症の画像所見
晩発性皮膚型ポルフィリン症、肝性骨髄性ポルフィリン症、先天性骨髄性ポルフィリン症、骨髄性プロトポルフィリン症などの皮膚型ポルフィリン症では皮膚病変の評価が中心となります。
皮膚病変の評価で用いられる画像検査は以下のようなものです。
- 皮膚超音波検査
- ダーモスコピー
- 蛍光診断
皮膚超音波検査では病変部の皮膚肥厚や浮腫性変化を評価することができます。
ダーモスコピーは皮膚表面の微細な変化を観察するのに適しており、色素沈着や血管拡張などの特徴的な所見を捉えることが可能です。
蛍光診断はポルフィリン症の皮膚病変に特異的な検査法として注目されています。
ウッド灯を用いた蛍光観察によりポルフィリンの蓄積部位を視覚化することがで可能です。
| 病型 | 蛍光所見 |
| PCT | 赤色蛍光 |
| CEP | ピンク色蛍光 |
| EPP | 赤橙色蛍光 |
これらの画像検査を組み合わせることで皮膚型ポルフィリン症の診断精度を向上させることが可能になります。

所見:(a) Porphyria cutanea tarda(PCT)患者の右手で、多数のびらんと紅斑が見られる。(b) 右手のクローズアップ写真。
内臓病変の画像評価
ポルフィリン症では様々な内臓病変を伴うことがあり、その評価には多様な画像検査が活用されます。
特に肝臓の評価は重要で、行われる検査は次のようなものです。
- 腹部超音波検査
- 腹部CT
- 腹部MRI
- 肝エラストグラフィ
PCT患者の肝臓ではしばしば脂肪肝や肝硬変の所見が認められます。
超音波検査では肝実質のエコー輝度上昇や表面の凹凸不整などが観察されることがあるでしょう。
CTやMRIでは肝臓の形態変化や内部の不均一性を詳細に評価することができます。肝エラストグラフィは肝線維化の程度を非侵襲的に評価する手法として有用です。
| 検査法 | 評価項目 |
| 超音波 | 肝エコー輝度 |
| CT | 肝辺縁形状 |
| MRI | 肝内信号変化 |
| エラストグラフィ | 肝硬度 |
これらの検査結果を総合的に解釈することで、ポルフィリン症に伴う肝病変の状態を把握することが可能となります。
神経系の画像所見
急性型ポルフィリン症では中枢神経系や末梢神経系の障害を伴うことがあり、その評価には主にMRIが用いられるのです。
中枢神経系の画像所見としては以下のようなものが報告されています。
- 白質病変
- 皮質萎縮
- 可逆性後頭葉白質脳症(PRES)様の所見
末梢神経障害の評価にはMRニューログラフィーが有用であり、神経の腫大や信号強度の変化を捉えることが可能です。

所見:FLAIRにおいて、両側頭頂後頭部の皮質および皮質下領域に高信号が認められ、拡散強調画像では拡散制限は認めない。造影後の画像では、両側頭頂後頭部の皮質および皮質下領域に軽度の造影増強を認める。
これらの画像所見はポルフィリン症の神経学的合併症の診断や経過観察において大切な役割を果たします。
ポルフィリン症の画像診断は疾患の多様性を反映して複雑ですが、適切な検査法の選択と詳細な画像解析により、診断や経過観察に有用な情報を得ることができるのです。
画像所見を臨床症状や生化学的検査結果と総合的に解釈することで、より正確な診断と効果的な経過観察が可能となる可能性があります。

治療アプローチと回復への道のり
ポルフィリン症治療の基本原則
ポルフィリン症の治療は病型や症状の重症度に応じて個別化されます。
治療の主な目的は急性発作の管理、合併症の予防、長期的な症状のコントロールです。
各病型に対する治療アプローチは異なりますが、共通する原則としては誘発因子の回避、栄養管理、対症療法が挙げられます。
治療期間は個人差が大きく、一部の患者さんでは生涯にわたる管理が必要となることがあるでしょう。
急性型ポルフィリン症の治療
急性間欠性ポルフィリン症、遺伝性コプロポルフィリン症、異型ポルフィリン症、ALA脱水酵素欠損ポルフィリン症などの急性型ポルフィリン症の治療は急性発作の管理が中心となります。
急性発作時の主な治療法は以下の通りです。
- ヘミン投与
- 高濃度ブドウ糖輸液
- 疼痛管理
- 電解質補正
| 治療法 | 目的 |
| ヘミン投与 | ヘム合成抑制 |
| ブドウ糖輸液 | 代謝安定化 |
| 鎮痛薬 | 疼痛緩和 |
| 電解質補正 | 恒常性維持 |
ヘミン投与は急性発作の標準的な治療法として広く用いられています。通常では3〜4日間の連日投与が行われ、症状の改善が見られます。
急性発作の回復期間は個人差が大きいですが、多くの場合で1〜2週間程度で症状が軽快しています。ただし完全な回復には数ヶ月を要することもあるでしょう。
皮膚型ポルフィリン症の治療
晩発性皮膚型ポルフィリン症、肝性骨髄性ポルフィリン症、先天性骨髄性ポルフィリン症、骨髄性プロトポルフィリン症などの皮膚型ポルフィリン症では皮膚症状の管理が治療の中心となります。
主な治療法は以下の通りです。
- 瀉血療法(PCT)
- ヒドロキシクロロキン投与(PCT)
- 遮光対策
- ベータカロテン投与(EPP)
| 病型 | 主な治療法 |
| PCT | 瀉血、ヒドロキシクロロキン |
| CEP | 遮光、輸血 |
| EPP | ベータカロテン、遮光 |
PCTの治療では瀉血療法が効果的です。この治療法では2〜4週間隔で瀉血を繰り返し、6〜12ヶ月程度で皮膚症状の改善が見られることが多いです。
EPPではベータカロテンの内服と厳重な遮光対策が行われます。
治療効果の発現には個人差がありますが、通常2〜3ヶ月程度で症状の軽減が期待できます。
長期管理と再発予防
ポルフィリン症の多くは完全な治癒が難しく、長期的な管理が必要となります。
再発予防のための主な対策は以下の通りです。
- 誘発因子の回避
- 定期的な検査と経過観察
- 栄養管理
- ストレス軽減
長期管理において重要な点として以下が挙げられます。
- 定期的な医療機関への受診
- 薬物療法の継続(必要な場合)
- 生活習慣の改善
- 合併症のスクリーニング
これらの対策を継続することで、多くの患者さんが良好な状態を維持できることが報告されています。
新規治療法の展望
ポルフィリン症の治療法は近年の研究により新たな展開を見せています。
遺伝子治療や RNA 干渉療法など革新的なアプローチが臨床試験段階にあります。
これらの新規治療法は従来の対症療法とは異なって疾患の根本的な原因に介入することを目指しています。
| 治療法 | 標的 |
| 遺伝子治療 | 変異遺伝子の修復 |
| RNA干渉療法 | 異常タンパク質の抑制 |
| 酵素補充療法 | 欠損酵素の補充 |
これらの新しいアプローチは、将来的にポルフィリン症の治療成績を大きく向上させる可能性を秘めています。
ただし現時点ではまだ研究段階にあり、実用化までには更なる検討が必要です。

治療の副作用とリスク
ポルフィリン症治療における副作用の概要
ポルフィリン症の治療は患者さんの生活の質を向上させる一方で、様々な副作用やリスクを伴う可能性があります。
これらの副作用は使用される薬剤や治療法によって異なり、また個人の体質や病状によっても変化します。
医療従事者は治療のベネフィットとリスクのバランスを慎重に評価し、患者さんと十分なコミュニケーションを取りながら治療方針を決定することが求められます。
副作用の中には軽微なものから重篤なものまで幅広く存在し、それぞれに対する適切な対応が必要です。
急性型ポルフィリン症治療の副作用
急性間欠性ポルフィリン症、遺伝性コプロポルフィリン症、異型ポルフィリン症、ALA脱水酵素欠損ポルフィリン症などの急性型ポルフィリン症の治療では主にヘミン製剤と高濃度ブドウ糖輸液が用いられます。
これらの治療法に伴う主な副作用とリスクは以下の通りです。
- 静脈炎
- 鉄過剰症
- 血栓症
- 電解質異常
| 治療法 | 主な副作用 |
| ヘミン投与 | 静脈炎、鉄過剰症 |
| ブドウ糖輸液 | 電解質異常、浮腫 |
ヘミン投与による静脈炎は比較的頻度の高い副作用であり、投与部位の痛みや腫れを引き起こす可能性があります。
また、長期的なヘミン投与は鉄過剰症のリスクを高める可能性があるため定期的な血中フェリチン値のモニタリングが重要です。
高濃度ブドウ糖輸液は電解質バランスの乱れや浮腫を引き起こすことがあります。特に心臓や腎臓に問題がある患者さんでは注意が必要です。
皮膚型ポルフィリン症治療の副作用
晩発性皮膚型ポルフィリン症、肝性骨髄性ポルフィリン症、先天性骨髄性ポルフィリン症、骨髄性プロトポルフィリン症などの皮膚型ポルフィリン症の治療では瀉血療法やヒドロキシクロロキン投与などが行われます。
これらの治療に伴う主な副作用とリスクは以下のようなものです。
- 貧血
- 網膜症
- 光線過敏症の悪化
- 肝機能障害
| 治療法 | 主な副作用 |
| 瀉血療法 | 貧血、めまい |
| ヒドロキシクロロキン | 網膜症、消化器症状 |
瀉血療法は貧血やめまい、倦怠感などを引き起こす可能性があります。特に高齢者や心疾患を有する患者さんでは、慎重な管理が必要です。
ヒドロキシクロロキンは長期使用によって網膜症のリスクが上昇することが知られています。
定期的な眼科検診が重要であり、視力低下や視野異常などの症状が現れた際は速やかに医療機関に相談することが必要です。
長期管理に伴うリスク
ポルフィリン症の長期管理には継続的な薬物療法や生活習慣の制限が含まれることがあり、これらに伴う様々なリスクが存在します。
長期管理に伴う主なリスクは以下のようなものです。
- 薬物依存
- 肝機能障害
- 骨密度低下
- 心理的ストレス
継続的な薬物療法は肝臓や腎臓への負担を増加させる可能性があり、定期的な肝機能検査や腎機能検査が重要です。
また、ステロイド剤の長期使用が必要となる場合では骨密度低下や糖尿病のリスクが上昇することがあります。
厳格な生活習慣の制限は患者さんに心理的ストレスを与える可能性があり、QOLの低下につながることがあるでしょう。
| リスク要因 | 潜在的影響 |
| 薬物の長期使用 | 臓器障害、薬物依存 |
| 生活制限 | 心理的ストレス、QOL低下 |
これらのリスクを最小限に抑えるためには定期的な健康チェックと適切な心理的サポートが必要不可欠です。
新規治療法のリスク
ポルフィリン症の新規治療法として遺伝子治療やRNA干渉療法などが研究されていますが、これらの治療法にも潜在的なリスクが存在します。
新規治療法に伴う主なリスクは次の通りです。
- 免疫反応
- 遺伝子導入に伴う突然変異
- 長期的な安全性の不確実性
- 予期せぬ副作用
遺伝子治療ではウイルスベクターを使用することが多く、これに対する免疫反応が問題となる可能性があります。
また、遺伝子の挿入位置によっては新たな遺伝子異常を引き起こすリスクも指摘されているのです。
RNA干渉療法では標的以外の遺伝子発現にも影響を与える可能性(オフターゲット効果)があり、予期せぬ副作用が生じる可能性が考えられます。
これらの新規治療法はまだ長期的な安全性が確立されておらず、慎重な経過観察が必要です。
ポルフィリン症の治療には様々な副作用やリスクが伴う可能性があり、これらを十分に理解し、適切に管理することが極めて重要です。

再発リスクと予防戦略
ポルフィリン症の再発リスク概要
ポルフィリン症は遺伝的要因と環境因子の相互作用により発症する代謝疾患であり、多くの患者さんで再発のリスクが存在します。
再発の頻度や程度は病型によって異なり、個人の生活習慣や環境要因にも大きく影響される傾向です。
急性型ポルフィリン症では誘発因子への曝露により急性発作が繰り返し起こる可能性があります。
一方、皮膚型ポルフィリン症では適切な管理下でも光線過敏症状が再燃することがあるのです。
再発予防のためには長期的かつ包括的なアプローチが不可欠であり、医療従事者と患者さんの密接な連携が求められます。
急性型ポルフィリン症の再発予防
急性間欠性ポルフィリン症、遺伝性コプロポルフィリン症、異型ポルフィリン症、ALA脱水酵素欠損ポルフィリン症などの急性型ポルフィリン症では誘発因子の回避が再発予防の鍵です。
主な誘発因子には以下のようなものがあります。
- 特定の薬剤
- アルコール
- 喫煙
- ストレス
- 低炭水化物食
| 誘発因子 | 予防策 |
| 薬剤 | 安全薬リストの活用 |
| アルコール | 禁酒または制限 |
| 喫煙 | 禁煙 |
| ストレス | ストレス管理技法の習得 |
安全薬リストを常に携帯し、新しい薬剤を使用する際は必ず医療従事者に相談することが重要です。
また、規則正しい生活リズムの維持やバランスの取れた食事の摂取も再発予防に有効です。
皮膚型ポルフィリン症の再発予防
晩発性皮膚型ポルフィリン症、肝性骨髄性ポルフィリン症、先天性骨髄性ポルフィリン症、骨髄性プロトポルフィリン症などの皮膚型ポルフィリン症では主に日光曝露の管理が再発予防の中心となります。
効果的な遮光対策には以下のようなものがあります。
- UVカット効果の高い日焼け止めの使用
- 遮光性の高い衣服の着用
- サンバイザーや帽子の使用
- 日中の外出を避ける
| 予防策 | 効果 |
| UVカット日焼け止め | 紫外線遮断 |
| 遮光性衣服 | 皮膚の保護 |
| 日中の外出制限 | 曝露リスク低減 |
PCTではアルコール摂取や鉄分の過剰摂取を避けることも再発予防に重要です。EPPではベータカロテンの継続的な摂取が推奨されることがあります。
定期的な肝機能検査や血中ポルフィリン濃度のモニタリングによって再発のリスクを評価し、必要に応じて予防的介入を行うことが可能です。
長期的な再発予防戦略
ポルフィリン症の再発予防には長期的な視点に立った包括的な戦略が必要になります。
以下のような要素を組み合わせた総合的なアプローチが効果的です。
- 定期的な医療機関への受診
- 生活習慣の改善
- ストレス管理
- 栄養管理
- 家族や周囲の理解と支援
定期的な医療機関への受診は疾患の状態を把握し、早期に再発の兆候を発見するために極めて重要です。
生活習慣の改善には適度な運動や十分な睡眠の確保が含まれます。
これらは全身状態の安定化に寄与し、間接的に再発リスクを低減する効果があります。
| 予防戦略 | 目的 |
| 定期受診 | 早期発見・介入 |
| 生活改善 | 全身状態安定化 |
| ストレス管理 | 誘発因子の制御 |
ストレス管理は特に急性型ポルフィリン症の再発予防に重要です。瞑想やヨガなどのリラクゼーション技法の習得が有効な場合があります。
栄養管理ではバランスの取れた食事の摂取と必要に応じた栄養補助が推奨されます。特に炭水化物の適切な摂取は急性型ポルフィリン症の再発予防に不可欠です。
遺伝カウンセリングと家族支援
ポルフィリン症は遺伝性疾患であるため家族内での発症リスクの評価と予防策の共有が大切です。
遺伝カウンセリングを通じて以下のような情報提供と支援が行われます。
- 遺伝形式の説明
- 家族内スクリーニングの推奨
- 保因者検査の案内
- 家族計画に関する相談
家族の理解と支援は患者さんの長期的な疾患管理と再発予防に大きな役割を果たします。
家族を含めた包括的な教育プログラムの提供が再発予防の効果を高める可能性があるでしょう。

ポルフィリン症の治療費
ポルフィリン症の治療費は難病指定により一部軽減される場合があります。
検査費用は病型や状態により変動し、数万円から十万円以上になることもあります。
難病指定を受けると自己負担上限額が設定され、経済的負担が軽減されます。
初診・再診料と検査費用
初診料は2,910円~5,410円で、再診料は750円~2,660円です。
検査費用は病型により異なり、尿中ポルフィリン検査で170~510円、遺伝子検査では10万円以上かかることがあります。
| 項目 | 費用 |
| 初診料 | 2,910円~5,410円 |
| 再診料 | 750円~2,660円 |
| 尿中ポルフィリン検査 | ポルフィリン症スクリーニングテスト(尿)170円 |
入院費用と処置費
急性発作時の入院では1日あたり1万円から3万円程度の費用が発生します。ヘミン投与などの処置費用は1回あたり5万円から10万円程度かかることがあります。
詳しく説明すると、日本の入院費計算システムは、「DPC(診断群分類包括評価)」という方式で入院費を算出します。これは患者さんの病気や治療内容に応じて費用を決める仕組みです。
DPCの特徴:
約1,400種類の病気グループに分類
1日ごとの定額制
一部の特殊な治療は別途計算
昔の「出来高」方式と比べると、DPCでは多くの診療行為が1日の定額に含まれます。
DPCと出来高方式の違い:
・出来高で計算されるもの:手術、リハビリ、特定の処置など
・DPCに含まれるもの:薬、注射、検査、画像診断など
計算方法:
(1日の基本料金) × (入院日数) × (病院ごとの係数) + (別途計算される治療費)
例えば、患者が14日間入院した場合の計算は以下のようになります。
DPC名: 代謝障害(その他) 手術なし 手術処置等2なし
日数: 14
医療機関別係数: 0.0948 (例:神戸大学医学部附属病院)
入院費: ¥342,020 +出来高計算分
医療費の支払いについて、もう少し詳しく説明します。
1, 健康保険の適用
・保険が使える場合、患者さんが支払う金額は全体の10%から30%になります。
・年齢や収入によって、この割合が変わります。
- 高額医療費制度
・医療費が一定額を超えると、この制度が適用されます。
・結果として、実際に支払う金額がさらに少なくなることがあります。
- 料金の変更について
・ここでお話しした金額は2024年8月時点のものです。
・医療費は状況によって変わることがあるので、最新の情報は病院や健康保険組合に確認するのがよいでしょう。
難病指定による自己負担軽減
ポルフィリン症は指定難病に含まれており、認定を受けると自己負担上限額が設定されます。
世帯収入に応じて月額上限が決まり、例えば年収300万円以下の世帯では月額上限が1万円程度となります。
| 世帯年収 | 月額上限 |
| 300万円以下 | 1万円程度 |
| 300〜600万円 | 2万円程度 |
以上