脂質蓄積症(リピドーシス)とは、体内で脂質を分解する酵素に異常が生じ、細胞内に脂質が過剰に蓄積する病気のことです。
この病気では、通常なら分解されるはずの脂質が、体の様々な組織や臓器に徐々に蓄積していきます。
脂質蓄積症には複数の種類があり、それぞれ異なる酵素の欠損や機能不全が原因となっています。
症状は蓄積する脂質の種類や場所によって多岐にわたり、神経系や内臓に影響を及ぼすことがあります。
病型
脂質蓄積症(ししつちくせきしょう)には様々な病型が存在しますが その中でも特に注目すべき二つの病型としてコレステリルエステル蓄積症とウォルマン病があります。
これらの病型はそれぞれ異なる遺伝子の変異によって引き起こされ体内での脂質代謝に重大な影響を及ぼすとともに、患者様の生活に大きな変化をもたらす可能性があります。
両疾患とも早期の診断と適切な対応が患者様の生活の質を維持する上で不可欠となり、医療従事者と患者様の緊密な連携が求められます。
コレステリルエステル蓄積症の特徴
コレステリルエステル蓄積症はリソソーム酸性リパーゼ(LAL)という酵素の欠損によって生じる遺伝性疾患であり、長期的な健康管理が必要となる慢性的な代謝異常の一つです。
この疾患ではコレステリルエステルやトリグリセリドなどの脂質が肝臓や脾臓 血管壁などの様々な組織に蓄積していき、時間の経過とともに臓器機能に影響を及ぼす可能性があります。
以下の表はコレステリルエステル蓄積症の主な特徴をまとめたものです。
| 特徴 | 詳細 |
| 発症年齢 | 小児期から成人期 |
| 主な蓄積物質 | コレステリルエステル、トリグリセリド |
| 影響を受ける主な臓器 | 肝臓、脾臓、血管 |
| 遺伝形式 | 常染色体劣性遺伝 |
コレステリルエステル蓄積症の患者様では肝機能障害や心血管系の問題が生じやすくなることがあり、長期的な健康管理の観点から定期的なフォローアップが重要となります。
そのため定期的な医療機関の受診と生活習慣の見直しなどが求められることが少なくなく、患者様自身による自己管理能力の向上も期待されます。
ウォルマン病の特徴
一方 ウォルマン病はコレステリルエステル蓄積症と同じくLAL酵素の欠損によって引き起こされますが、より重度の形態として知られており乳児期からの集中的な医療介入が必要となる場合が多いです。
この疾患は主に乳児期に発症し急速に進行する場合があるため、早期発見と迅速な対応が患者様の予後に大きな影響を与える可能性があります。
ウォルマン病の主な特徴は以下の通りです。
- 乳児期早期からの症状出現
- 重度の肝腫大と脾腫
- 副腎の石灰化
- 栄養吸収障害
ウォルマン病の患者様では 脂質の蓄積が全身の臓器に及ぶことがあり、多岐にわたる症状が現れる可能性があるため多くの専門医による総合的なアプローチが求められます。
以下の表はウォルマン病とコレステリルエステル蓄積症の比較を示しています。
| 特徴 | ウォルマン病 | コレステリルエステル蓄積症 |
| 発症年齢 | 乳児期 | 小児期〜成人期 |
| 進行速度 | 急速 | 比較的緩徐 |
| 重症度 | 重度 | 軽度〜中等度 |
| 生命予後 | 不良のことが多い | 比較的良好 |
遺伝子変異と病型の関連性
脂質蓄積症の各病型はLIPA遺伝子の変異によって引き起こされ、この遺伝子の異常が脂質代謝システム全体に波及的な影響を及ぼします。
この遺伝子はリソソーム酸性リパーゼ(LAL)の産生に関与しており、その変異の種類や程度によって ウォルマン病やコレステリルエステル蓄積症などの異なる病型が生じ、患者様ごとに症状の現れ方や進行速度が異なることがあります。
遺伝子変異と病型の関連性について以下のポイントが挙げられます。
- 完全な酵素活性の喪失がウォルマン病を引き起こす
- 部分的な酵素活性の低下がコレステリルエステル蓄積症を引き起こす
- 同じ遺伝子の変異でも その位置や種類により症状の重症度が異なる
以下の表はLIPA遺伝子の変異と病型の関連をまとめたものです。
| 遺伝子変異の特徴 | 関連する病型 |
| 完全な機能喪失型変異 | ウォルマン病 |
| 部分的な機能低下型変異 | コレステリルエステル蓄積症 |
| 複合ヘテロ接合体変異 | 症状の程度が様々 |
遺伝子検査技術の進歩により、これらの変異を正確に同定することが可能となり個々の患者様の状態をより詳細に把握できるようになってきました。
このような遺伝子レベルでの理解は、将来的な治療法の開発や個別化医療の実現に向けて大切な基盤となり患者様一人ひとりに最適な医療を提供する可能性を広げています。
以下の表は脂質蓄積症の診断に用いられる主な検査方法をまとめたものです。
| 検査方法 | 目的 |
| 遺伝子検査 | LIPA遺伝子の変異を特定 |
| 酵素活性測定 | LAL酵素の機能を評価 |
| 生化学検査 | 血中脂質値を測定 |
| 画像診断 | 臓器の腫大や脂肪蓄積を確認 |
脂質蓄積症の各病型について理解を深めることは患者様やそのご家族 医療従事者の方々にとって重要であり、疾患管理の質の向上につながります。

脂質蓄積症(リピドーシス)の主症状
脂質蓄積症(ししつちくせきしょう)は、体内の様々な組織や臓器に脂質が異常に蓄積することで引き起こされる代謝疾患群であり、その症状は蓄積する脂質の種類や場所によって多岐にわたります。
患者様の年齢や病型によって症状の現れ方や進行速度が異なるため、個々の症例に応じた注意深い観察と対応が求められます。
脂質蓄積症の主症状は、大きく分けて全身性の症状と特定の臓器に関連する症状に分類されますが、これらが複合的に現れることも少なくありません。
全身性の症状
脂質蓄積症の全身性の症状は、体内の広範囲にわたる脂質の蓄積によって引き起こされ、患者様の日常生活に大きな影響を与える可能性があります。
以下に、代表的な全身性の症状をまとめます。
- 発育遅延や成長障害
- 易疲労感や全身倦怠感
- 皮膚の変化(黄色腫や皮膚の乾燥)
- 筋力低下や運動機能の低下
これらの症状は、患者様の生活の質を大きく左右するため、早期からの適切な対応が重要となります。
| 症状 | 特徴 |
| 発育遅延 | 身長や体重の増加が同年齢の平均を下回る |
| 易疲労感 | 日常的な活動でも疲れやすい |
| 皮膚変化 | 黄色腫や乾燥肌が目立つ |
| 筋力低下 | 運動能力の低下や動作の緩慢化 |
臓器特異的な症状
脂質蓄積症では、特定の臓器に脂質が蓄積することで、その臓器特有の症状が現れることがあります。
これらの症状は、病型や進行度によって異なりますが、主に以下の臓器に関連する症状が報告されています。
- 肝臓および脾臓の症状
- 肝腫大や脾腫
- 腹部膨満感
- 黄疸
- 神経系の症状
- 発達遅滞や知的障害
- 運動失調
- けいれん発作
- 骨・関節の症状
- 骨痛や関節痛
- 骨変形
- 成長障害
- 心血管系の症状
- 心肥大
- 不整脈
- 動脈硬化の進行
これらの症状は、患者様の年齢や病型によって出現時期や程度が異なるため、個別の状況に応じた対応が必要です。
| 臓器 | 主な症状 |
| 肝臓・脾臓 | 腫大、黄疸 |
| 神経系 | 発達遅滞、けいれん |
| 骨・関節 | 骨痛、変形 |
| 心血管系 | 心肥大、不整脈 |
コレステリルエステル蓄積症の特徴的な症状
コレステリルエステル蓄積症は、主に肝臓や脾臓、血管壁にコレステリルエステルが蓄積する病型であり、その症状は緩やかに進行することが多いです。
この病型に特徴的な症状として、以下のようなものが挙げられます。
- 肝腫大と脾腫
- 高コレステロール血症
- 早発性動脈硬化
- 黄色腫(皮膚や腱に現れる脂肪の沈着)
これらの症状は、患者様の生活習慣や環境因子によっても影響を受ける可能性があるため、総合的な評価と長期的な経過観察が大切です。
| 症状 | 詳細 |
| 肝腫大・脾腫 | 触診や画像検査で確認可能 |
| 高コレステロール血症 | 血液検査で高値を示す |
| 早発性動脈硬化 | 若年期から血管壁の肥厚が進行 |
| 黄色腫 | 皮膚や腱に黄色い隆起性病変が出現 |
ウォルマン病の特徴的な症状
ウォルマン病は、コレステリルエステル蓄積症の重症型として知られており、主に乳児期に発症し急速に進行することが特徴です。
この病型では、以下のような症状が早期から顕著に現れることがあります。
- 重度の肝腫大と脾腫
- 栄養吸収障害による成長障害(脂肪の消化吸収不良による下痢・嘔吐、体重増加不良)
- 副腎の石灰化
ウォルマン病の症状は、生後数週間から数か月のうちに急速に進行することが多く、早期の診断と対応が患者様の予後に大きな影響を与える可能性があります。

原因やきっかけ
脂質蓄積症(ししつちくせきしょう)は、主に遺伝子の変異に起因する代謝性疾患であり、その発症には複雑な遺伝的メカニズムが関与しています。
この疾患群では、脂質代謝に関わる特定の遺伝子に変異が生じることで、体内での脂質の分解や輸送に障害が起こり、結果として様々な組織や臓器に脂質が蓄積することとなり、患者様の健康状態に大きな影響を及ぼす可能性があります。
遺伝形式は多くの場合常染色体劣性遺伝であり、両親から変異遺伝子を受け継ぐ必要があります。
以下の表は、脂質蓄積症の主な遺伝的特徴をまとめたものです。
| 特徴 | 詳細 |
| 遺伝形式 | 常染色体劣性遺伝 |
| 関連遺伝子 | LIPA, SMPD1, GALC など |
| 変異の影響 | 酵素活性の低下や欠損 |
| 保因者 | 通常無症状 |
酵素欠損と代謝異常
脂質蓄積症の直接的な原因は、脂質代謝に関わる特定の酵素の欠損や機能不全にあり、これらの酵素は通常、体内での脂質の分解や輸送を担っていますが、遺伝子変異によってその機能が失われると、代謝のバランスが崩れ、脂質の蓄積が進行します。
例えば、コレステリルエステル蓄積症とウォルマン病では、リソソーム酸性リパーゼ(LAL)という酵素の欠損が原因となっており、この酵素欠損により、体内の脂質代謝に重大な影響が生じます。
この酵素欠損により、以下のような代謝異常が引き起こされます。
- コレステリルエステルの分解障害
- トリグリセリドの蓄積
- リソソーム機能の低下
- 細胞内脂質代謝の破綻
酵素欠損の程度によって、疾患の重症度や発症時期が異なることがあり、個々の患者様の状態を正確に把握することが大切です。
環境因子と脂質蓄積症
遺伝的要因が主な原因であり、環境因子による発症予防はできません。
ただし適切な食事管理などにより症状悪化を抑える事が出来る可能性はあります。
特に食生活や生活習慣は、体内の脂質バランスに大きく関わるため、遺伝的素因を持つ個人においてこれらの因子が疾患の進行に影響を与える可能性があります。
以下の表は、脂質蓄積症に影響を与える可能性がある環境因子をまとめたものです。
| 環境因子 | 影響 |
| 食生活 | 脂質摂取量や質の変化 |
| 運動習慣 | 脂質代謝への影響 |
| ストレス | ホルモンバランスの変化 |
| 薬物 | 代謝への影響 |
これらの環境因子は直接的な原因ではありませんが、遺伝的素因を持つ個人において疾患の発症や進行を促進する可能性があります。
コレステリルエステル蓄積症の特異的原因
コレステリルエステル蓄積症は、LIPA遺伝子の変異によって引き起こされる疾患であり、この遺伝子は、リソソーム酸性リパーゼ(LAL)の産生に関与しており、その変異によって酵素活性が低下または消失することで、体内の脂質代謝に重大な影響を及ぼします。
LAL酵素の機能不全により、以下のような代謝異常が生じます。
- コレステリルエステルの分解障害
- 遊離コレステロールの産生低下
- トリグリセリドの蓄積
- リソソーム機能の全体的な低下
これらの代謝異常は長期にわたって徐々に進行し、様々な組織や臓器に影響を与える可能性があります。
以下の表は、コレステリルエステル蓄積症における遺伝子変異と酵素活性の関係をまとめたものです。
| 遺伝子変異の種類 | 酵素活性への影響 |
| ミスセンス変異 | 部分的な活性低下 |
| ナンセンス変異 | 完全な活性消失 |
| スプライシング変異 | 変動的な活性低下 |
| 欠失変異 | 重度の活性低下または消失 |
ウォルマン病の特異的原因
ウォルマン病もまたLIPA遺伝子の変異が原因ですが、コレステリルエステル蓄積症よりも重度の酵素欠損を伴い、この疾患ではLAL酵素の活性がほぼ完全に失われることが多く、その結果より急速かつ重篤な脂質蓄積が起こります。
ウォルマン病の特徴的な代謝異常には、以下のようなものがあります。
- コレステリルエステルの著しい蓄積
- トリグリセリドの急速な蓄積
- リソソーム機能の重度の障害
- 細胞内脂質代謝の完全な破綻
これらの代謝異常は乳児期から急速に進行することが多く、早期の対応が重要となります。
以下の表は、コレステリルエステル蓄積症とウォルマン病の原因の比較をまとめたものです。
| 特徴 | コレステリルエステル蓄積症 | ウォルマン病 |
| 遺伝子変異 | LIPA遺伝子 | LIPA遺伝子 |
| 酵素活性 | 部分的低下 | ほぼ完全な欠損 |
| 発症時期 | 小児期〜成人期 | 乳児期 |
| 進行速度 | 緩徐 | 急速 |
脂質蓄積症の原因やきっかけを理解することは、患者様の状態を適切に把握し、個々の状況に応じた対応を行う上で大変重要です。

診察と診断
脂質蓄積症(ししつちくせきしょう)の診断において、初期の診察は極めて重要な役割を果たし、患者様の健康状態を総合的に評価する上で欠かせない段階となります。
医師は患者様の詳細な病歴聴取と身体診察を行い、疑わしい症状や所見を注意深く評価し、さらに家族歴や環境要因についても丁寧に聞き取りを行います。
この初期段階での正確な情報収集が、その後の診断プロセスの方向性を決定する鍵となり、適切な検査計画の立案にも大きく寄与します。
| 初期診察の項目 | 内容 |
| 病歴聴取 | 家族歴、発達歴、既往歴 |
| 身体診察 | 肝脾腫、皮膚所見、神経学的所見 |
| 成長発達評価 | 身長、体重、発達マイルストーン |
| 栄養状態評価 | 食事内容、摂取量、消化器症状 |
血液検査による評価
血液検査は脂質蓄積症の診断において不可欠な手段であり、患者様の体内で起こっている代謝異常を客観的に評価するための重要なツールとなります。
特に血中の脂質プロファイルや酵素活性の測定は、疾患の存在を示唆する重要な指標となり、診断の確実性を高めるために欠かせません。
コレステリルエステル蓄積症やウォルマン病では、リソソーム酸性リパーゼ(LAL)活性の低下が特徴的であり、この酵素活性の測定が診断の決め手となることがあります。
以下に、脂質蓄積症の診断に用いられる主な血液検査項目を示します。
- 総コレステロール
- LDLコレステロール
- HDLコレステロール
- トリグリセリド
- LAL酵素活性
- 肝機能検査(AST、ALT、γ-GTP)
これらの検査結果は疾患の可能性を評価する上で重要な情報を提供し、さらなる精密検査の必要性を判断する基準となります。
| 血液検査項目 | 診断的意義 |
| 総コレステロール | 脂質代謝異常の指標 |
| LAL酵素活性 | 疾患特異的な酵素欠損の評価 |
| 肝機能検査 | 肝臓への影響の評価 |
| 血球計数 | 貧血や血小板減少の確認 |
画像診断の役割
画像診断は、脂質蓄積症による臓器への影響を視覚的に評価する上で大切な手段であり、患者様の体内で起こっている変化を非侵襲的に観察することができます。
特に肝臓や脾臓の腫大、骨の変化などを確認するために用いられ、疾患の進行度や合併症の有無を評価する上で重要な情報を提供します。
| 画像検査 | 主な評価対象 |
| 腹部超音波 | 肝臓、脾臓の大きさと構造 |
| CT | 臓器の詳細な形態、石灰化 |
| MRI | 軟部組織の詳細な評価 |
| 骨X線 | 骨の変形や密度変化 |
これらの画像検査を組み合わせることで疾患の進行度や臓器への影響を総合的に評価でき、患者様の状態をより正確に把握することが可能となります。
遺伝子検査の意義
脂質蓄積症の確定診断には遺伝子検査が重要な役割を果たし、患者様の遺伝的背景を明らかにすることで、より精密な診断と予後予測が可能となります。
LIPA遺伝子の変異を同定することで、コレステリルエステル蓄積症やウォルマン病の診断を確定でき、さらに変異の種類によって病型の特定も可能となります。
遺伝子検査は、以下のような利点があります。
- 確定診断の提供
- 病型の特定
- 家族内の保因者スクリーニング
- 遺伝カウンセリングへの情報提供
遺伝子検査の結果は、患者様とそのご家族にとって重要な情報となるため、適切な遺伝カウンセリングとともに実施されることが望ましく、結果の解釈や今後の対応について専門家の助言が求められます。
| 遺伝子検査の種類 | 特徴 |
| 全エクソーム解析 | 全ての遺伝子領域を網羅的に解析 |
| 特定遺伝子パネル検査 | 脂質代謝関連遺伝子を集中的に解析 |
| 単一遺伝子検査 | LIPA遺伝子のみを対象に解析 |
| 家族内変異検査 | 既知の家族性変異を対象に解析 |
鑑別診断の実施
脂質蓄積症の診断過程では類似した症状を呈する他の疾患との鑑別が必要であり、医師は患者様の症状や検査結果を総合的に評価し、他の可能性がある疾患を慎重に除外していきます。
このプロセスは、正確な診断を行う上で不可欠であり、各疾患に特異的な検査や所見を慎重に評価することで、最終的な診断に到達します。
| 鑑別すべき疾患 | 共通する特徴 |
| 家族性高コレステロール血症 | 高コレステロール血症 |
| 非アルコール性脂肪性肝疾患 | 肝機能異常、肝腫大 |
| ゴーシェ病 | 肝脾腫、骨病変 |
| ニーマン・ピック病 | 肝脾腫、神経症状 |
脂質蓄積症の診察と診断は複合的なアプローチを必要とする綿密なプロセスであり、初期診察から遺伝子検査に至るまで、各段階での正確な評価と判断が求められます。

脂質蓄積症(リピドーシス)の画像所見
脂質蓄積症(ししつちくせきしょう)の診断と経過観察において、画像診断は極めて重要な役割を果たし、患者様の体内で起こっている変化を可視化することで、より正確な病態把握を可能にします。
様々な画像モダリティを用いることで、体内の脂質蓄積状態や臓器への影響を非侵襲的に評価することが可能となり、患者様の状態を正確に把握するための貴重な情報源となり、さらに経時的な変化を追跡することで疾患の進行度を評価することもできます。
画像所見は、疾患の進行度や治療効果の判定にも活用され、患者様の長期的な管理において不可欠な要素となっており、個々の患者様に最適な対応を行うための基盤となります。
肝臓と脾臓の画像所見
肝臓と脾臓は、脂質蓄積症において最も顕著な変化が見られる臓器の一つであり、これらの臓器の画像所見は、疾患の診断や進行度の評価に重要な情報を提供し、患者様の全身状態を反映する指標となります。
以下に、肝臓と脾臓の主な画像所見をまとめます。
- 肝臓の腫大(肝腫大)
- 脾臓の腫大(脾腫)
- 肝実質の輝度上昇(超音波検査)
- 肝実質の CT 値低下
- 脂肪肝様の所見
これらの所見は、脂質の蓄積による臓器の変化を反映しており、疾患の進行とともに顕著になる傾向があり、患者様の状態を経時的に評価する上で重要な指標となります。
| 画像検査 | 肝臓の所見 | 脾臓の所見 |
| 超音波 | 輝度上昇、腫大 | 腫大 |
| CT | 低吸収域、腫大 | 腫大 |
| MRI | T1強調像で高信号、T2強調像で低信号 | 腫大、信号強度変化 |
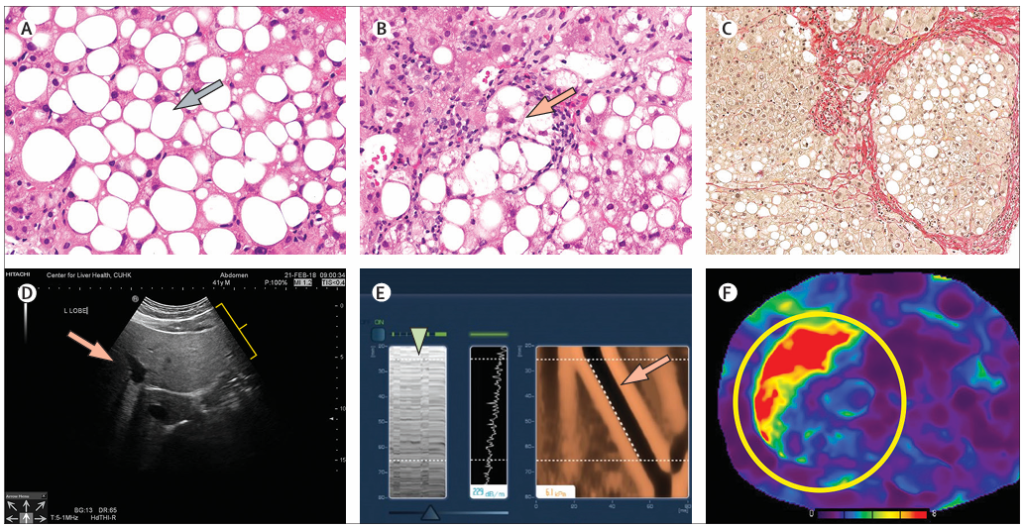
所見:非アルコール性脂肪肝疾患(NAFLD)の組織学的および放射線学的評価。
(A) 非アルコール性脂肪肝は、大きな円形の非染色領域が肝細胞内の脂肪滴を表す(灰色矢印、ヘマトキシリン・エオシン染色、拡大×40)巨胞性脂肪変性を特徴とし、壊死性炎症はほとんどまたは全く見られない。
(B) 脂肪蓄積に加えて、非アルコール性脂肪肝炎(NASH)は小葉性炎症および肝細胞の風船様変性の存在を特徴とする。画像中央には、炎症細胞に囲まれた風船様変性肝細胞が見られる(赤色矢印、ヘマトキシリン・エオシン染色、拡大×40)。
(C) 病気が進行すると、肝線維症の蓄積が最終的に肝硬変を引き起こす。この画像の右側には、厚い線維組織に囲まれた肝硬変結節がある。場合によっては、病気が肝硬変に進行するにつれて脂肪変性および壊死性炎症が減少または消失し、これを「燃え尽きたNASH」と呼ぶ(シリウスレッド染色、拡大×10)。
(D) 脂肪肝の診断に最も一般的な方法である超音波検査では、明るい肝エコーテクスチャー(黄色の括弧)および深部構造のぼやけ(赤色矢印)が特徴である。
(E) 振動制御一過性エラストグラフィー(Vibration-controlled transient elastography)は、肝線維症の評価のための肝硬度のポイント・オブ・ケア測定であり、制御減衰パラメータを使用して肝脂肪を評価することもできる。機器は肝実質の位置を特定するためのMモード超音波を備えている(緑色の三角形)。エラストグラム(赤色矢印)は肝硬度の測定を表している。傾きが急なほど、せん断波の速度が高く、肝臓が硬いことを示している。
(F) NASH肝硬変患者の磁気共鳴エラストグラフィーは、現在、最も正確な非侵襲的評価方法の一つとされている。
骨病変の画像所見
脂質蓄積症、特にゴーシェ病などでは骨に特徴的な変化が見られることがあり、これらの骨病変はX線検査やMRI、骨密度測定などによって評価され、患者様の骨の健康状態を総合的に判断するための重要な情報源となります。
主な骨の画像所見には以下のようなものがあります。
- エルレンマイヤーフラスク変形(大腿骨遠位端や脛骨近位端)
- 骨髄置換(MRIでの信号強度変化)
- 骨壊死(特に大腿骨頭)
- 骨密度低下
これらの所見は疾患の進行度や骨への影響を評価する上で重要な指標となり、患者様の運動機能や生活の質に直接関わる要素として注目されます。
| 骨病変 | X線所見 | MRI所見 |
| エルレンマイヤーフラスク変形 | 骨端部の膨らみ | – |
| 骨髄置換 | – | T1強調像で低信号、T2強調像で高信号 |
| 骨壊死 | 骨硬化、骨頭圧潰 | 特徴的な信号変化パターン |
| 骨密度低下 | 骨皮質の菲薄化 | – |
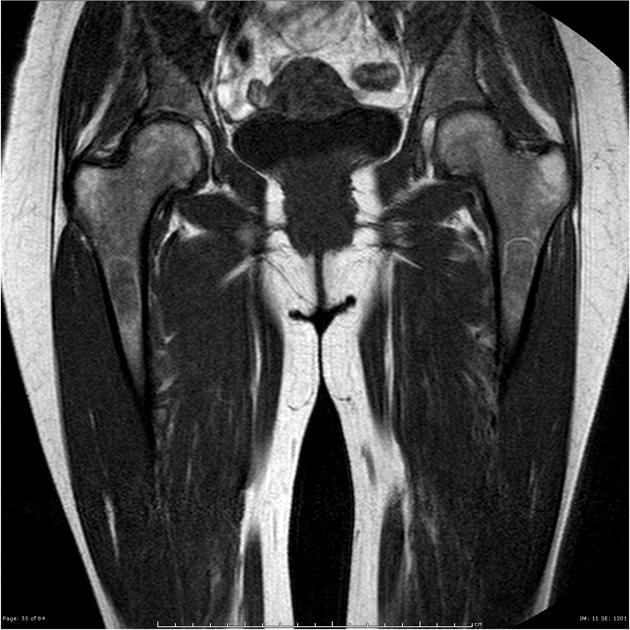
所見:大腿骨全体に軽度不均一な信号異常を認め、大腿骨頭骨端および両側の大転子骨端にまで広がっている。遠位大腿骨骨端にも部分的な関与が認められる。斑状のT2WI信号域は左側が右側よりも広範囲である。骨壊死の証拠は認められない。
中枢神経系の画像所見
一部の脂質蓄積症では中枢神経系にも影響が及ぶことがあり、その評価には主にMRIが用いられ、高解像度で詳細な脳の構造や機能的変化を捉えることができます。
中枢神経系の画像所見は、疾患の神経学的合併症を評価する上で重要であり、患者様の認知機能や運動機能の変化を理解する手がかりとなります。
代表的な中枢神経系の画像所見には以下のようなものがあります。
- 白質の信号変化(脱髄パターン)
- 脳萎縮
- 基底核の信号異常
- 小脳萎縮
これらの所見は疾患の中枢神経系への影響を示唆し、神経学的症状との関連を評価する際に参考となり、患者様の長期的な神経学的予後を予測する上で重要な情報を提供します。
| 中枢神経系の部位 | MRI所見 | 臨床的意義 |
| 大脳白質 | T2/FLAIR高信号 | 脱髄、神経変性 |
| 大脳皮質 | 萎縮 | 認知機能低下 |
| 基底核 | T1低信号、T2高信号 | 運動障害 |
| 小脳 | 萎縮 | 協調運動障害 |
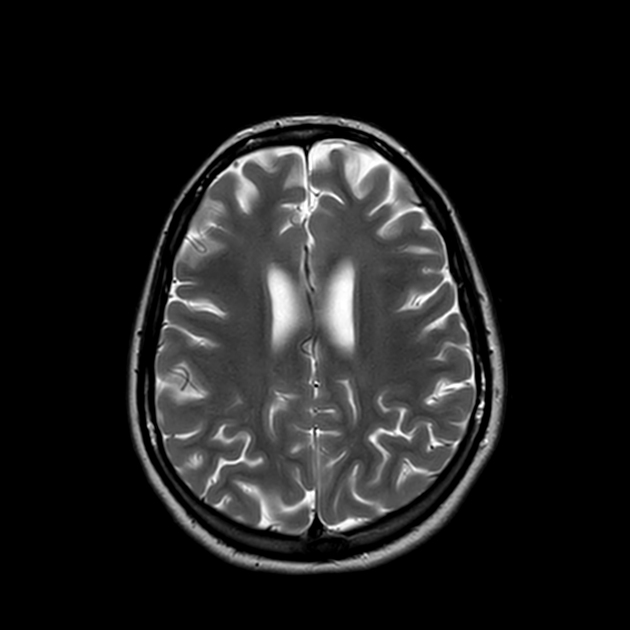
所見:びまん性中等度の脳萎縮と軽度の脳室周囲および皮質下白質のT2WI高信号を認めるが、U線維は温存されている。
血管系の画像所見
脂質蓄積症、特にコレステリルエステル蓄積症では血管系にも変化が見られることがあり、これらの所見は動脈硬化のリスク評価や心血管系合併症の予測に役立ち、患者様の長期的な心血管健康管理に重要な指針を提供します。
主な血管系の画像所見には以下のようなものがあります。
- 頸動脈内膜中膜複合体肥厚(頸動脈エコー)
- 冠動脈石灰化(冠動脈CT)
- 大動脈壁肥厚(CT、MRI)
| 血管検査 | 評価対象 | 主な所見 |
| 頸動脈エコー | 頸動脈 | 内膜中膜複合体肥厚 |
| 冠動脈CT | 冠動脈 | 石灰化、狭窄 |
| 大血管MRI | 大動脈 | 壁肥厚、プラーク |
これらの画像所見は脂質蓄積症の全身への影響を評価する上で重要な情報を提供し、患者様の心血管リスクを総合的に判断するための基盤となります。
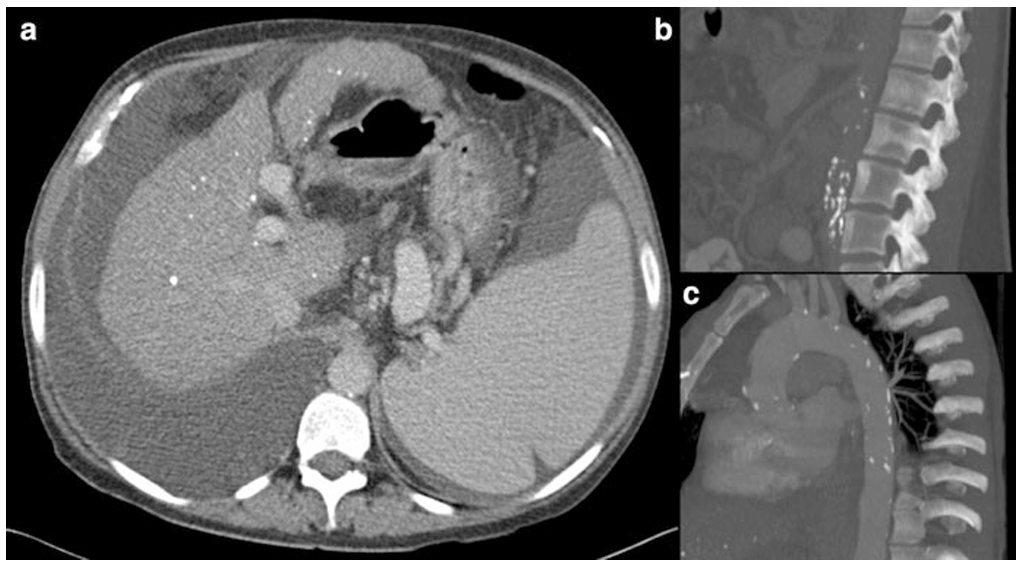
所見:42歳女性のCESDによる末期肝疾患。肝移植前に取得された画像。(a) 造影後の上腹部の軸位CT画像では、結節性の肝臓に複数の小さな石灰化病変が認められ、脾腫、腹水、および中等度の右側胸水が伴っている。 (b) および(c) 非造影の主要動脈の矢状断CT画像では、腹部および胸部大動脈に広範な石灰化が認められる。

治療方法と薬、治癒までの期間
脂質蓄積症(リピドーシス)の治療は、患者様の状態や病型に応じて個別化されたアプローチが必要となります。
治療の主な目的は、蓄積した脂質の除去や代謝異常の改善、症状の緩和、合併症の予防などが挙げられます。
現在完全な治癒は困難ですが、長期的な管理により症状の改善や進行の抑制が期待できます。
治療期間は生涯にわたることが多く、定期的な評価と調整が重要となります。
酵素補充療法
酵素補充療法は、脂質蓄積症の一部の病型に対して有効な治療法です。
この治療法では、欠損している酵素を人工的に補充することで、体内の脂質代謝を改善することを目指します。
特に、ゴーシェ病やファブリー病などでは、この治療法が広く用いられています。
以下に、酵素補充療法の特徴をまとめます。
- 定期的な点滴投与が必要
- 効果の発現には数か月から数年かかることがある
- 生涯にわたる継続が必要
| 疾患名 | 補充酵素 | 投与間隔 |
| ゴーシェ病 | イミグルセラーゼ | 2週間ごと |
| ファブリー病 | アガルシダーゼベータ | 2週間ごと |
| ポンペ病 | アルグルコシダーゼアルファ | 2週間ごと |
基質合成抑制療法
基質合成抑制療法は、蓄積する脂質の産生を抑制することで症状の改善や進行の抑制を目指す治療法です。
この治療法は、特にゴーシェ病やニーマン・ピック病タイプCなどで用いられています。
経口薬による治療が可能であり、患者様の負担が比較的少ないという利点があります。
主な基質合成抑制薬とその特徴は以下の通りです。
- ミグルスタット
- エリグルスタット
- ルセラスタット
これらの薬剤は、長期的な服用が必要となり、効果の発現には数か月から1年程度かかることがあります。
| 薬剤名 | 主な適応疾患 | 投与方法 |
| ミグルスタット | ゴーシェ病、ニーマン・ピック病C型 | 経口 |
| エリグルスタット | ゴーシェ病 | 経口 |
| ルセラスタット | ファブリー病 | 経口 |
遺伝子治療
遺伝子治療は、脂質蓄積症の根本的な治療法として期待されている先進的なアプローチです。
この治療法では変異した遺伝子を正常な遺伝子に置き換えることで、欠損酵素の産生を回復させることを目指します。
現在、複数の脂質蓄積症に対する遺伝子治療の臨床試験が進行中です。
遺伝子治療の主な特徴は以下の通りです。
- 一回の治療で長期的な効果が期待できる
- 全身性の効果が得られる可能性がある
- 安全性と長期的な効果の確認が進行中
遺伝子治療は、まだ研究段階にあり、実用化までには更なる検討が必要です。
支持療法と症状管理
脂質蓄積症の治療において支持療法と症状管理は重要な役割を果たします。
これらの治療は患者様の生活の質を向上させ、合併症のリスクを低減することを目的としています。
主な支持療法と症状管理の方法には、以下のようなものがあります。
- 痛み管理
- 栄養サポート
- リハビリテーション
- 心理的サポート
これらの治療は、患者様の個別のニーズに応じて調整され、長期的に継続されます。
| 支持療法 | 目的 | 実施頻度 |
| 理学療法 | 運動機能の維持・改善 | 週1-3回 |
| 作業療法 | 日常生活動作の支援 | 週1-2回 |
| 心理カウンセリング | 精神的サポート | 月1-2回 |
| 栄養指導 | 適切な栄養摂取の支援 | 3-6か月ごと |
治療効果のモニタリングと期間
脂質蓄積症の治療効果は、定期的なモニタリングによって評価されます。
治療の継続期間は生涯にわたることが多く、効果の発現には個人差があります。
一般的に、治療開始後数か月から1年程度で何らかの改善が見られることが多いですが、完全な症状の消失は難しいのが現状です。
治療効果のモニタリングには、以下のような項目が含まれます。
- 血液検査(酵素活性、バイオマーカーなど)
- 画像検査(MRI、CT、超音波など)
- 身体機能評価
- 生活の質(QOL)評価
これらの評価を定期的に行うことで治療の効果を確認し、必要に応じて治療内容を調整します。
| 評価項目 | 評価頻度 | 目的 |
| 血液検査 | 3-6か月ごと | 酵素活性、バイオマーカーの確認 |
| 画像検査 | 6-12か月ごと | 臓器の状態、脂質蓄積の評価 |
| 身体機能評価 | 3-6か月ごと | 運動機能、日常生活動作の確認 |
| QOL評価 | 6-12か月ごと | 生活の質、心理状態の評価 |
脂質蓄積症の治療は、長期的かつ多面的なアプローチが必要です。
完全な治癒は現時点では困難ですが、適切な治療を継続することで、症状の改善や進行の抑制が可能です。

治療の副作用やデメリット(リスク)
脂質蓄積症(リピドーシス)の治療において酵素補充療法は有効な選択肢の一つですが、いくつかの副作用やリスクが報告されており、これらは患者様の生活の質に影響を与える可能性があるため、医療従事者と患者様の双方が注意深く観察する必要があります。
酵素補充療法に関連する主な副作用には以下のようなものがあり、これらの多くは投与初期に発生しやすく、時間の経過とともに軽減することがありますが、継続的な監視と適切な対応が求められます。
- 点滴反応(発熱、悪寒、発疹など)
- アレルギー反応
- 抗体産生
- 頭痛
- 吐き気
これらの副作用は、患者様の体調や生活リズムに大きな影響を与える可能性があるため、個別の状況に応じた対策を講じることが重要です。
| 副作用 | 発生頻度 | 対処法 |
| 点滴反応 | 10-20% | 投与速度の調整、前投薬 |
| アレルギー反応 | 1-5% | 抗ヒスタミン薬、ステロイド |
| 抗体産生 | 10-30% | 定期的なモニタリング |
| 頭痛 | 5-15% | 鎮痛剤 |
| 吐き気 | 5-10% | 制吐剤 |
基質合成抑制療法のデメリット
基質合成抑制療法は、経口投与が可能という利点がありますが、いくつかのデメリットやリスクも存在します。
これらは治療の継続性や効果に影響を与える可能性があるため、十分な注意が必要であり患者様の生活様式や他の健康状態を考慮しながら、適切な対応策を講じることが求められます。
基質合成抑制療法の主なデメリットには以下のようなものがあり、これらは患者様ごとに発現の程度が異なるため個別の対応が重要となり、定期的な評価と調整が必要です。
- 消化器症状(下痢、腹痛、鼓腸など)
- 体重減少
- 神経系への影響(振戦、しびれなど)
- 薬物相互作用のリスク
これらのデメリットは、患者様の日常生活や社会活動に大きな影響を与える可能性があるため、包括的なサポート体制を整えることが重要です。
| デメリット | 発生頻度 | 影響 |
| 消化器症状 | 30-50% | QOLの低下、栄養吸収への影響 |
| 体重減少 | 10-20% | 全身状態への影響 |
| 神経系への影響 | 5-15% | 日常生活動作への支障 |
| 薬物相互作用 | 個別に評価 | 他の薬剤の効果への影響 |
長期治療に伴うリスク
脂質蓄積症の治療は長期にわたることが多く、それに伴ういくつかのリスクが存在し、これらは患者様の身体的・精神的健康に影響を与える可能性があるため定期的な評価と対策が重要であり、患者様の生活全般をサポートする包括的なアプローチが求められます。
長期治療に伴う主なリスクには以下のようなものがあり、これらは患者様の生活全般に影響を与える可能性があるため、医療、心理、社会的側面からの総合的なサポートが必要となります。
- 治療への依存性
- 心理的負担
- 経済的負担
- 社会生活への影響
- 二次的な健康問題(骨粗鬆症、感染リスクの上昇など)
これらのリスクに対しては患者様の個別の状況に応じた対策を講じることが重要であり、多職種連携によるサポート体制の構築が求められます。
| リスク | 影響範囲 | 対策 |
| 治療への依存性 | 身体的・心理的 | 自己管理能力の向上支援 |
| 心理的負担 | 精神的健康 | 心理カウンセリング |
| 経済的負担 | 家計、生活設計 | 医療費助成制度の活用 |
| 社会生活への影響 | 就労、人間関係 | 社会支援サービスの利用 |
遺伝子治療の潜在的リスク
遺伝子治療は、脂質蓄積症の根本的な治療法として期待されていますが、いくつかの潜在的なリスクが懸念されています。
これらのリスクは治療の安全性と長期的な効果に関わる重要な課題であるため、慎重な研究と評価が継続的に行われています。
遺伝子治療の主な潜在的リスクには以下のようなものがあり、これらは現在も研究段階にあり臨床応用に向けてさらなる検討が必要であるため、患者様への適用にあたっては十分な説明と同意が不可欠です。
- 挿入突然変異のリスク
- 免疫反応
- オフターゲット効果
- 長期的な安全性の不確実性
これらのリスクに対しては継続的な研究と技術開発が進められており、安全性と有効性の向上に向けた取り組みが行われています。
| リスク | 懸念事項 | 研究の焦点 |
| 挿入突然変異 | がん化のリスク | 安全なベクターの開発 |
| 免疫反応 | 治療効果の減弱 | 免疫調節戦略の確立 |
| オフターゲット効果 | 予期せぬ遺伝子変異 | 精密な遺伝子編集技術の開発 |
| 長期的安全性 | 未知の副作用 | 長期フォローアップ研究 |
治療効果の個人差とその影響
脂質蓄積症の治療効果には個人差があり、これが患者様やご家族にとって心理的な負担となる可能性があります。
この個人差は遺伝的要因や環境要因、治療への反応性などによって生じ予測が難しいことがあるため、患者様一人ひとりに対する丁寧な説明とサポートが重要となります。
個人差によって生じる主な影響には以下のようなものがあり、これらは患者様の治療へのモチベーションや心理状態に大きく関わるため、医療従事者による継続的な支援と適切な情報提供が不可欠です。
- 治療効果の不確実性によるストレス
- 期待と現実のギャップによる落胆
- 治療の継続性への影響
- 医療者との信頼関係への影響
これらの影響に対しては、患者様の個別の状況に応じた心理的サポートや情報提供を行うことが重要であり、患者様と医療従事者の良好なコミュニケーションが求められます。

脂質蓄積症(リピドーシス)の再発の可能性と予防の仕方
脂質蓄積症は遺伝子の変異に起因する代謝疾患であるため、従来の意味での「再発」という概念は適用されません。
しかしながら、症状の悪化や新たな合併症の出現を「再発」と捉えることがあり、これらの状況を予防することが患者様の生活の質を維持する上で重要となります。
コレステリルエステル蓄積症やウォルマン病などの脂質蓄積症では長期的な管理が必要であり、症状の変動や進行を注意深く観察することが求められます。
| 状況 | 特徴 | 対応 |
| 症状の悪化 | 既存の症状が増悪 | 早期発見と介入 |
| 新規合併症 | 新たな臓器障害の出現 | 定期的な全身評価 |
| 治療効果の減弱 | 既存治療の効果低下 | 治療法の再検討 |
| 生活習慣の乱れ | 食事・運動管理の不徹底 | 生活指導の強化 |
再発リスクの評価
脂質蓄積症の「再発」リスクを評価することは、患者様の長期的な管理において重要です。
リスク評価には、遺伝的要因、環境要因、治療への反応性など、多角的な視点が必要となります。
定期的な医学的評価と患者様の生活状況の把握を組み合わせることで、より正確なリスク評価が可能となります。
以下に、再発リスク評価の主な項目を示します。
- 遺伝子変異の種類と程度
- 酵素活性レベル
- 臓器機能の状態
- 血中脂質プロファイル
- 生活習慣の遵守度
- ストレスレベル
これらの項目を総合的に評価することで、個々の患者様に適したリスク管理戦略を立てることができます。
| リスク因子 | 評価方法 | 評価頻度 |
| 遺伝子変異 | 遺伝子検査 | 診断時 |
| 酵素活性 | 血液検査 | 3-6か月ごと |
| 臓器機能 | 画像検査 | 6-12か月ごと |
| 血中脂質 | 血液検査 | 1-3か月ごと |
定期的なモニタリングの重要性
脂質蓄積症の管理において、定期的なモニタリングは症状の悪化や合併症の早期発見に不可欠です。
医療機関での定期検査と日々の自己観察を組み合わせることで、より効果的な疾患管理が可能となります。
モニタリングの主な項目には以下のようなものがあります。
- 血液検査(酵素活性、脂質プロファイルなど)
- 画像検査(臓器の状態評価)
- 身体機能評価
- 生活の質(QOL)評価
これらの項目を定期的に評価することで、病状の変化を早期に捉え、適切な対応を取ることができます。
心理的サポートの役割
脂質蓄積症の長期管理において、心理的サポートは重要な役割を果たします。
患者様やご家族の精神的健康を維持することは、疾患管理の継続性や生活の質の向上に大きく寄与します。
心理的サポートの主な目的には以下のようなものがあります。
- ストレス管理
- 不安や抑うつの軽減
- 疾患受容の促進
- 自己効力感の向上
これらの目的を達成するために、専門家によるカウンセリングや患者会への参加などが有効です。
| サポート形態 | 内容 | 期待される効果 |
| 個別カウンセリング | 専門家との1対1の面談 | 個別の悩みへの対応 |
| グループセラピー | 同じ疾患の患者様との交流 | 経験の共有、孤独感の軽減 |
| 家族支援 | 家族向けの教育と相談 | 家族の理解促進、支援体制の強化 |
| セルフヘルプグループ | 患者会への参加 | 情報交換、相互支援 |
脂質蓄積症の「再発」予防と管理は、医療的介入と生活習慣の改善を組み合わせた包括的なアプローチが重要です。

脂質蓄積症(リピドーシス)の治療費について
脂質蓄積症の治療費は病型や重症度により大きく異なりますが、長期的な管理が必要なため高額になる傾向があります。
検査費用
定期的な血液検査や画像検査が必要で、1回あたり5,000円から30,000円程度かかります。遺伝子検査は高額で、38,800円~80,000円がベースですが、場合に寄っては更に高額になることもあります。
| 検査項目 | 概算費用 |
| 血液検査 | 5,000円~10,000円 |
| MRI検査 | 19,000円~30,200円 |
| 遺伝子検査 | 38,800円~80,000円+α |
治療費用
酵素補充療法では、1回の点滴で95,046~986,972円かかることがあります。基質合成抑制薬の場合、1っかいあたり61,600~156,700円の薬剤費がかかる場合もあります。
また、更に高額な治療も存在しているため、注意が必要です。
| 治療法 | 概算費用(1回あたり, 70kgの場合) |
| 酵素補充療法 | ・アガルシダーゼベータBS点滴静注5mg 70498円×14 = 986,972円 ・セレザイム静注用400単位 262526円×1.05 = 275,652円 ・マイオザイム点滴静注用50mg 67890円×1.4 = 95,046円 |
| 基質合成抑制薬 | ・ブレーザベスカプセル100mg 10266.7円×6 = 61,600円 ・サデルガカプセル100mg 78350.5円×2 = 156,700円 ・ガラフォルドカプセル123mg 145,304円 |
入院費用
合併症の管理や集中的な治療が必要な場合、入院が必要になることがあります。1日あたりの入院費は30,000円から70,000円程度です。
脂質蓄積症の治療費は高額になる可能性が高いですが、各種制度を活用することで患者負担を軽減できる場合があります。医療ソーシャルワーカーに相談することが大切です。
詳しく説明すると、日本の入院費はDPC(診断群分類包括評価)システムを使用して計算されます。このシステムは、患者の病名や治療内容に基づいて入院費を決定する方法です。以前の「出来高」方式とは異なり、DPCシステムでは多くの診療行為が1日あたりの定額に含まれます。
DPCシステムの主な特徴
- 約2,600以上の分類に分類される
- 1日あたりの定額制
- 一部の治療は従来通りの出来高計算が適用される
DPCシステムと出来高計算の比較表
| DPC(1日あたりの定額に含まれる項目) | 出来高計算項目 |
|---|---|
| 投薬 | 手術 |
| 注射 | リハビリ |
| 検査 | 特定の処置 |
| 画像診断 | |
| 入院基本料 |
DPCシステムの計算方法
計算式は以下の通りです:
「1日あたりの金額」×「入院日数」×「医療機関別係数」+「出来高計算分」
*医療機関別係数は各医療機関によって異なります。
例えば、患者が14日間入院した場合の計算は以下のようになります。
DPC名: 代謝障害(その他) 手術なし 手術処置等2なし
日数: 14
医療機関別係数: 0.0948 (例:神戸大学医学部附属病院)
入院費: ¥447,020 +出来高計算分
保険が適用されると、自己負担額は1割から3割になります。また、高額医療制度の対象となる場合、実際の自己負担額はさらに低くなります。
なお、上記の価格は2024年7月時点のものであり、最新の価格については随時ご確認ください。
以上