代謝疾患の一種である遺伝性ヘモクロマトーシスとは体内の鉄分が過剰に蓄積される遺伝性の病気です。
英語ではHereditary Hemochromatosisと呼ばれるこの疾患は主に特定の遺伝子の変異によって引き起こされます。
通常私たちの体は必要な量の鉄分を吸収して余分な分は排出しますが、この病気では鉄分の吸収が過剰になってしまいます。
その結果、肝臓や心臓、膵臓などの臓器に鉄が蓄積してさまざまな健康上の問題を引き起こす可能性が生じるのです。
神戸きしだクリニック公式Youtubeチャンネルでの音声解説はこちら。
病型について
遺伝性ヘモクロマトーシスの4つの主要病型
遺伝性ヘモクロマトーシスには主に4つの病型が存在しており これらはそれぞれ異なる遺伝子の変異に関連しています。
各病型は発症年齢や症状の進行速度 鉄の蓄積パターンなどに違いがあるため正確な診断と病型の特定が患者さんの経過観察において重要な役割を果たします。
1型ヘモクロマトーシス
1型ヘモクロマトーシスは遺伝性ヘモクロマトーシスの中で最も一般的な病型です。
この病型はHFE遺伝子の変異によって引き起こされ、主に欧米の白人集団で多く見られます。
| 特徴 | 詳細 |
| 遺伝子 | HFE |
| 発症年齢 | 40~60歳 |
| 遺伝形式 | 常染色体劣性遺伝 |
1型ヘモクロマトーシスでは通常、中年期以降に症状が顕在化することが多く、徐々に進行する鉄の過剰蓄積が特徴です。
2型ヘモクロマトーシス(若年性ヘモクロマトーシス)
2型ヘモクロマトーシスは若年性ヘモクロマトーシスとも呼ばれ、他の病型と比べて早期に発症するのが特徴です。
この病型はさらに2つのサブタイプに分けられます。
- 2A型 HJV遺伝子の変異による
- 2B型 HAMP遺伝子の変異による
2型ヘモクロマトーシスでは10代から30代の若年層で症状が現れることがあり、鉄の蓄積速度が速いことが知られています。
3型ヘモクロマトーシス(変異型ヘモクロマトーシス)
3型ヘモクロマトーシスは変異型ヘモクロマトーシスとも呼ばれ、TFR2遺伝子の変異によって引き起こされます。
この病型は1型ヘモクロマトーシスと比較的似た臨床経過をたどりますが、発症年齢や症状の進行に若干の違いがあるのです。
| 特徴 | 1型 | 3型 |
| 遺伝子 | HFE | TFR2 |
| 発症年齢 | 40~60歳 | 30~50歳 |
| 鉄蓄積速度 | 中程度 | やや速い |
3型ヘモクロマトーシスでは 1型よりもやや早い年齢で発症する傾向があり、鉄の蓄積速度も若干速いことがあります。
4型ヘモクロマトーシス(フェロポルチン病)
4型ヘモクロマトーシスはフェロポルチン病としても知られ、SLC40A1遺伝子の変異によって引き起こされるのです。
この病型は他の3つの病型とは異なる特徴を持っており、遺伝形式や鉄の蓄積パターンに違いがあります。
| 特徴 | 詳細 |
| 遺伝子 | SLC40A1 |
| 遺伝形式 | 常染色体優性遺伝 |
| 鉄蓄積の特徴 | マクロファージ優位 |
4型ヘモクロマトーシスの特徴は次の通りです。
- 他の病型と異なり常染色体優性遺伝形式をとる
- マクロファージ(体内の清掃細胞)に鉄が蓄積しやすい
- 血清フェリチン値が高値を示すが 血清鉄やトランスフェリン飽和度は正常範囲内のことがある
これらの4つの主要病型に加え、まれに他の遺伝子変異による非典型的な遺伝性ヘモクロマトーシスも報告されています。

主症状とその特徴
初期症状と進行性の変化
遺伝性ヘモクロマトーシスの症状は一般的に緩やかに進行し、初期段階では特異的な症状が現れないことが多いのが特徴です。
しかし時間の経過とともに体内の鉄蓄積量が増加するにつれ、さまざまな臓器に影響が及び 多様な症状が現れるようになります。
初期段階で見られる非特異的な症状は以下のようなものです。
- 慢性的な疲労感
- 関節痛
- 腹痛
これらの症状は日常生活の中で気づきにくいことがあるため早期発見が困難な場合が多いでしょう。
肝臓への影響と関連症状
遺伝性ヘモクロマトーシスにおいて肝臓は鉄過剰の影響を最も受けやすい臓器の一つです。
肝臓への鉄蓄積が進むと次のような症状や合併症が現れる可能性があります。
| 症状・合併症 | 特徴 |
| 肝腫大 | 触診で確認できる場合あり |
| 右上腹部痛 | 持続的または断続的 |
| 黄疸 | 進行例で出現することも |
肝機能障害が進行すると肝硬変や肝細胞癌のリスクが高まることがあるため定期的な経過観察が重要です。
内分泌系への影響と関連症状
遺伝性ヘモクロマトーシスでは膵臓や下垂体などの内分泌器官にも鉄が蓄積してさまざまなホルモン異常を引き起こす可能性があります。
以下はその代表的な内分泌系の症状です。
| 症状 | 関連する内分泌器官 |
| 糖尿病 | 膵臓 |
| 性機能低下 | 下垂体・性腺 |
| 甲状腺機能低下 | 甲状腺 |
特に糖尿病は遺伝性ヘモクロマトーシスの比較的早期から現れることがある症状の一つであり注意が必要です。
心臓への影響と循環器症状
心臓への鉄蓄積は遺伝性ヘモクロマトーシスの重要な合併症の一つです。
心臓に鉄が蓄積すると以下のような症状や所見が現れることがあるでしょう。
- 不整脈
- 心不全症状(息切れ 浮腫など)
- 胸痛
これらの症状は生活の質に大きな影響を与える可能性があるため早期発見と適切な対応が求められます。
皮膚症状と外見的変化
遺伝性ヘモクロマトーシスでは皮膚の色調変化が特徴的な症状の一つとして知られています。
| 皮膚症状 | 特徴 |
| 皮膚の色素沈着 | ブロンズ色に変化 |
| 掻痒感 | 全身性のかゆみ |
皮膚の色素沈着は特に日光露出部位で顕著になることがあり、「ブロンズ糖尿病」と呼ばれることもあります。
関節症状と骨格系への影響
遺伝性ヘモクロマトーシスでは関節にも鉄が蓄積し、さまざまな関節症状を引き起こす可能性があります。
代表的な関節症状は次の通りです。
- 関節痛(特に指の関節)
- 関節の腫れや変形
- 朝のこわばり
これらの症状は日常生活動作に影響を与えることがあり「、患者さんのQOL低下につながる可能性があります。
病型による症状の違い
遺伝性ヘモクロマトーシスの各病型によって症状の出現時期や進行速度に違いがあることが知られています。
| 病型 | 特徴的な症状 |
| 1型 | 中年期以降に徐々に進行 |
| 2型(若年性) | 若年期から重症化しやすい |
| 3型 | 1型に類似するが若干早期に発症 |
| 4型 | マクロファージ優位の鉄蓄積 |
特に2型(若年性)ヘモクロマトーシスでは他の型と比べて早期から重篤な症状が現れる傾向があるため注意が必要です。

原因とメカニズム解明
遺伝子変異と鉄代謝異常
遺伝性ヘモクロマトーシスは特定の遺伝子の変異によって引き起こされる代謝疾患です。
この疾患では体内の鉄代謝を制御する遺伝子に異常が生じることで 過剰な鉄分の吸収や蓄積が起こります。
鉄代謝に関与する主要な遺伝子は以下のようなものです。
- HFE遺伝子
- HJV遺伝子
- HAMP遺伝子
- TFR2遺伝子
- SLC40A1遺伝子
これらの遺伝子のいずれかに変異が生じると正常な鉄代謝のバランスが崩れ、結果として体内に鉄が蓄積していきます。
各病型と関連遺伝子
遺伝性ヘモクロマトーシスは変異する遺伝子によって複数の病型に分類されます。
各病型と関連する遺伝子の対応は次の通りです。
| 病型 | 関連遺伝子 |
| 1型 | HFE |
| 2A型 | HJV |
| 2B型 | HAMP |
| 3型 | TFR2 |
| 4型 | SLC40A1 |
これらの遺伝子変異はそれぞれ異なる機序で鉄代謝に影響を与え、結果として過剰な鉄分の蓄積を引き起こします。
ヘプシジンの役割と鉄代謝制御
遺伝性ヘモクロマトーシスの発症メカニズムを理解する上でヘプシジンという物質の役割が重要です。
ヘプシジンは主に肝臓で産生されるホルモンであり、体内の鉄代謝を調節する中心的な役割を果たします。
ヘプシジンの主な機能は以下の通りです。
- 腸管からの鉄吸収の抑制
- マクロファージからの鉄放出の制御
- 全身の鉄バランスの維持
遺伝性ヘモクロマトーシスではヘプシジンの産生や機能に異常が生じることで鉄代謝の制御が適切に行われなくなります。
1型ヘモクロマトーシスのメカニズム
1型ヘモクロマトーシスは最も一般的な病型であり、HFE遺伝子の変異が原因です。
HFE遺伝子の変異は以下のような影響を及ぼします。
| 影響 | 結果 |
| ヘプシジン産生低下 | 鉄吸収抑制機能の低下 |
| トランスフェリン受容体との相互作用異常 | 細胞内鉄濃度感知機能の低下 |
これらの異常により体内での鉄吸収が過剰となって徐々に臓器に鉄が蓄積していきます。
2型および3型ヘモクロマトーシスの発症機序
2型(若年性)ヘモクロマトーシスと3型(変異型)ヘモクロマトーシスはそれぞれ異なる遺伝子の変異によって引き起こされますが、いずれもヘプシジンの産生や機能に影響を与えます。
これらの病型における主な発症機序は以下の通りです。
- 2A型 HJV遺伝子の変異によるヘプシジンシグナル伝達の障害
- 2B型 HAMP遺伝子の変異によるヘプシジン自体の産生障害
- 3型 TFR2遺伝子の変異による鉄感知機構の異常
いずれの場合も結果としてヘプシジンの機能不全が生じて鉄代謝の制御が適切に行われなくなります。
4型ヘモクロマトーシス(フェロポルチン病)の特殊性
4型ヘモクロマトーシス(フェロポルチン病)は他の病型とは異なるメカニズムで発症します。
この病型はSLC40A1遺伝子の変異によって引き起こされ、次のような特徴を持つのです。
| 特徴 | 詳細 |
| 遺伝形式 | 常染色体優性遺伝 |
| 影響を受ける分子 | フェロポルチン(鉄輸送タンパク質) |
| 主な影響 | マクロファージからの鉄放出異常 |
フェロポルチンの機能異常によりマクロファージ内に鉄が蓄積して特徴的な鉄代謝異常が生じます。
環境要因と遺伝子変異の相互作用
遺伝性ヘモクロマトーシスの発症には遺伝子変異が主要な原因となりますが、環境要因も病気の進行に影響を与える可能性が生じます。
環境要因として考えられるものは以下の通りです。
- 食事からの鉄分摂取量
- アルコール摂取
- ウイルス性肝炎の合併
これらの要因が遺伝子変異と相互作用することで鉄の蓄積速度や臓器障害の程度に個人差が生じる可能性があります。
遺伝性ヘモクロマトーシスの原因を理解することは早期発見や適切な管理につながる重要な要素です。
遺伝子検査や家族歴の確認など 総合的なアプローチによって個々の患者さんに合わせた対応が可能となります。

診察と診断プロセス
初診時の問診と身体診察
遺伝性ヘモクロマトーシスの診断プロセスは詳細な問診と綿密な身体診察から始まり、患者さんの家族歴、既往歴、現在の症状などについて丁寧に聞き取りを行います。
特に注目すべき問診項目には以下のようなものです。
- 家族内での類似症状や診断歴
- 慢性的な倦怠感や関節痛の有無
- 皮膚の色調変化の自覚
身体診察では肝臓の腫大や関節の腫れ、皮膚の色素沈着などを注意深く観察します。
これらの情報は遺伝性ヘモクロマトーシスを疑う重要な手がかりとなるのです。
血液検査による鉄過剰の評価
遺伝性ヘモクロマトーシスの診断において血液検査は非常に重要な役割を果たします。
鉄過剰の程度を評価するために用いられる検査項目は次のようなものです。
| 検査項目 | 評価内容 |
| 血清フェリチン | 体内の鉄貯蔵量 |
| トランスフェリン飽和度 | 血中の鉄結合能 |
| 血清鉄 | 血液中の鉄濃度 |
これらの検査値が基準値を超えている場合には遺伝性ヘモクロマトーシスの可能性が高まります。
特に血清フェリチン値とトランスフェリン飽和度は診断の鍵となる重要な指標です。
肝機能検査と他の生化学的検査
遺伝性ヘモクロマトーシスでは肝臓が鉄過剰の影響を受けやすいため肝機能検査も診断に欠かせません。
主な肝機能検査項目は以下のようなものです。
- AST (GOT)
- ALT (GPT)
- γ-GTP
- アルカリホスファターゼ (ALP)
これらの値が上昇している場合に肝臓への鉄蓄積による影響が示唆されます。
また、血糖値や甲状腺機能検査なども併せて行うことで他の内分泌器官への影響も評価します。
画像診断による臓器鉄沈着の評価
遺伝性ヘモクロマトーシスの診断過程では画像診断も重要な役割を果たします。
MRIやCTなどの画像検査によって肝臓や他の臓器における鉄沈着の程度を視覚的に評価することが可能です。
| 画像検査 | 特徴 |
| MRI | 鉄沈着の定量的評価が可能 |
| CT | 肝臓の密度上昇を確認 |
特にMRIは非侵襲的に鉄沈着量を定量化できる点で有用性が高いとされています。
これらの画像検査結果は診断の確定や病状の進行度評価に役立ちます。
遺伝子検査による確定診断
遺伝性ヘモクロマトーシスの確定診断には遺伝子検査が大切な役割を果たします。
各病型に関連する遺伝子の変異を特定することで診断の確実性が高まります。
主な検査対象遺伝子は以下の通りです。
| 病型 | 検査対象遺伝子 |
| 1型 | HFE |
| 2型 | HJV HAMP |
| 3型 | TFR2 |
| 4型 | SLC40A1 |
遺伝子検査の結果は患者さんの病型の特定や家族のスクリーニングにも有用です。
ただし遺伝子検査の実施にあたっては遺伝カウンセリングなど十分な説明と同意が必要になります。
肝生検の役割と実施基準
肝生検は遺伝性ヘモクロマトーシスの診断において特定の状況下で考慮される検査方法です。
肝生検により以下のような情報が得られます。
- 肝臓組織中の鉄沈着量の定量
- 肝線維化や肝硬変の程度の評価
- 他の肝疾患の除外
ただし肝生検は侵襲的な検査であるため、その実施には慎重な判断が求められます。
通常非侵襲的な検査で診断が確定できない場合や肝障害の程度を詳細に評価する必要がある際に検討されるでしょう。
診断基準と鑑別診断
遺伝性ヘモクロマトーシスの診断には複数の検査結果を総合的に評価することが重要です。
一般的な診断基準には以下のような項目が含まれます。
- トランスフェリン飽和度の上昇 (>45%)
- 血清フェリチン値の上昇 (>300 ng/mL 男性 >200 ng/mL 女性)
- 特徴的な遺伝子変異の存在
- 他の鉄過剰疾患の除外
鑑別診断として考慮すべき疾患は以下の通りです。
- 二次性ヘモクロマトーシス
- アルコール性肝疾患
- 非アルコール性脂肪肝疾患
これらの疾患との区別を慎重に行うことで正確な診断が可能となります。
遺伝性ヘモクロマトーシスの診断プロセスは複雑ですが、早期発見と適切な対応によって患者さんのQOL向上につながる可能性があります。

特徴的な画像所見
MRIによる鉄沈着の評価
遺伝性ヘモクロマトーシスの画像診断においてMRIは非常に重要な役割を果たします。
MRIは非侵襲的に体内の鉄沈着を定量的に評価できる点で他の画像検査に比べて優れているのです。
鉄沈着の程度によってMRI信号強度が変化するため以下のような特徴的な所見が観察されます。
| シーケンス | 鉄沈着部位の特徴 |
| T1強調画像 | 低信号 |
| T2強調画像 | 著明な低信号 |
| T2*強調画像 | より顕著な低信号 |
特にT2*強調画像は鉄に対する感度が高く、軽度の鉄沈着でも検出が可能です。
これらの所見は主に肝臓で顕著ですが、膵臓や心臓などの他の臓器でも観察されることがあります。
肝臓MRIにおける特徴的所見
遺伝性ヘモクロマトーシスでは肝臓への鉄沈着が最も顕著であることが多いため肝臓MRIが診断において重要です。
肝臓MRIでは以下のような特徴的な所見が見られます。
- びまん性の信号低下
- 肝実質の不均一な信号強度
- 肝内脈管の相対的な高信号化
これらの所見は鉄沈着の程度や分布を反映しており、病状の進行度評価に役立つのです。
また、MRIを用いた定量的評価方法としてR2値やT2値の測定があります。
これらの値は肝臓内の鉄濃度と強い相関があり、数値化することで経時的な変化の追跡が可能となるのです。
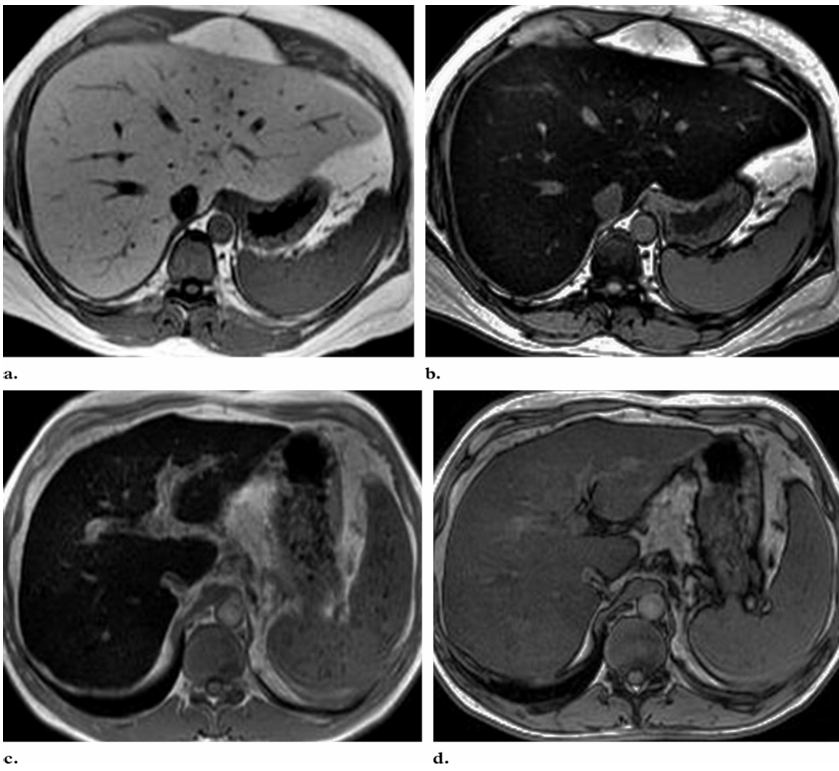
所見:(a, b) 脂肪肝。軸方向GRE T1強調同位相(a)および逆位相(b) MR画像では、逆相画像での肝臓の信号強度の低下(化学シフト)が示されている。(c, d) ヘモクロマトーシス。軸方向GRE T1強調同位相(c)および逆位相(d) MR画像では、同位相画像での肝臓の信号強度の低下(T2*効果)が示されている。
CTにおける遺伝性ヘモクロマトーシスの所見
CTはMRIほど鉄に対する感度は高くありませんが、遺伝性ヘモクロマトーシスの診断に補助的な役割を果たします。
CTでは鉄沈着により臓器の密度が上昇するため、観察される特徴的な所見は以下の通りです。
| 部位 | CT所見 |
| 肝臓 | びまん性の高吸収域 |
| 膵臓 | 密度上昇 |
| 脾臓 | 軽度の密度上昇 |
肝臓のCT値は通常50-70 HUですが、遺伝性ヘモクロマトーシスでは100 HUを超えることもあります。
ただしCTによる評価は定性的であり、軽度の鉄沈着の検出には限界があります。
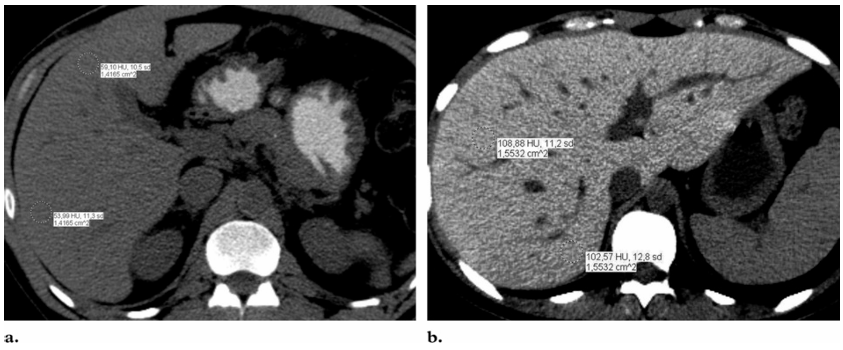
所見:血管内溶血と腎皮質への鉄沈着。(a) 軸方向GRE T1強調MR画像では、腎皮質が低信号で、髄質よりも信号強度が低くなっており、皮質髄質分化の逆転が生じている。(b) 冠状面single-shot fast SE T2強調MR画像では、腎皮質の低信号が強調されている。
超音波検査での画像所見
超音波検査は遺伝性ヘモクロマトーシスの診断において直接的な鉄沈着の評価は困難ですが、肝臓の状態を評価する上で有用な情報を提供します。
超音波検査で観察される可能性のある所見は次の通りです。
- 肝臓エコー輝度の上昇
- 肝実質の不均一なエコーパターン
- 肝腫大
これらの所見は鉄沈着による肝実質の変化を反映していますが非特異的であり、他の肝疾患でも類似の所見が見られることがあります。
超音波検査は簡便で非侵襲的なためスクリーニングや経過観察に適していますが、確定診断にはMRIなど他の画像検査との組み合わせが重要です。

所見:Bモード超音波検査において、肝実質は高エコーで粗いエコー輝度テクスチャを示している。S8の中心に、4.5 cmの境界明瞭な不均一エコー輝度テクスチャの腫瘤が認められる。
心臓MRIにおける鉄沈着評価
遺伝性ヘモクロマトーシスでは心臓への鉄沈着も起こる可能性があるため心臓MRIによる評価が重要です。
心臓MRIでは以下のような特徴的な所見が観察されます。
| 評価項目 | 特徴的所見 |
| T2*値 | 短縮 |
| 左室心筋 | 信号低下 |
| 心機能 | 低下の可能性 |
T2*値の短縮は心筋への鉄沈着を定量的に評価する指標として用いられます。
T2*値が20ミリ秒未満の場合では心筋への有意な鉄沈着が示唆されます。
心臓MRIは非侵襲的に心筋の鉄沈着と心機能を評価できる点で遺伝性ヘモクロマトーシスの管理に重要な役割を果たします。

所見:SSFP(TE 1.6、フリップ角45、BW 125、FOV 36、マトリックス = 224×224)を用いて取得された四腔心長軸ビュー。中隔および両心室の自由壁における信号の減衰が、標準的なSSFPイメージングで得られる心筋と比較して増加している。これらの所見は、心臓ヘモクロマトーシスの病理組織学的解析で一般的に観察される鉄沈着パターンと一致している。
その他の臓器における画像所見
遺伝性ヘモクロマトーシスでは肝臓や心臓以外の臓器にも鉄沈着が生じる可能性があります。
その他の臓器で観察される可能性のある画像所見は次の通りです。
- 膵臓 MRIでのT2*値短縮
- 下垂体 MRIでの信号低下
- 関節 X線での関節裂隙狭小化や骨棘形成
これらの所見は病状の進行度や全身への影響を評価する上で重要な情報となります。
多臓器にわたる画像評価を行うことで遺伝性ヘモクロマトーシスの全体像をより正確に把握することが可能となるのです。

遺伝性ヘモクロマトーシスの治療アプローチと経過
瀉血療法の基本原理と実施方法
遺伝性ヘモクロマトーシスの主要な治療法として瀉血療法が広く用いられています。
この治療法では体内に過剰に蓄積した鉄分を定期的に血液と共に体外に排出することで鉄過剰状態を改善することが目的です。
瀉血療法の一般的な実施方法は以下の通りです。
| 項目 | 詳細 |
| 頻度 | 週1〜2回 |
| 採血量 | 400〜500mL/回 |
| 期間 | 血清フェリチン値が正常化するまで |
瀉血療法の開始時期や頻度は患者さんの年齢や全身状態 鉄過剰の程度などを考慮して個別に決定されます。
治療の進行に伴って体内の鉄貯蔵量が減少するため瀉血の頻度は徐々に減らしていくことが一般的です。
キレート療法の役割と適応
瀉血療法が困難な患者さんや特定の状況下ではキレート療法が選択肢となります。
キレート療法は鉄と結合して体外に排出しやすい形にする薬剤を用いる治療法です。
主なキレート剤とその特徴は以下の通りです。
- デフェロキサミン 注射薬で長時間の持続投与が必要
- デフェラシロクス 経口薬で服用が比較的容易
キレート療法は以下のような状況で考慮されることがあります。
- 重度の貧血がある場合
- 心機能低下により瀉血が危険な場合
- 静脈アクセスが困難な場合
ただしキレート療法には副作用のリスクがあるため使用には慎重な判断が必要です。
各病型に応じた治療アプローチ
遺伝性ヘモクロマトーシスの各病型によって治療アプローチに若干の違いがあることがあります。
| 病型 | 治療の特徴 |
| 1型 | 標準的な瀉血療法が有効 |
| 2型 | 早期からの積極的治療が必要 |
| 3型 | 1型に準じた治療 |
| 4型 | 貧血に注意しながらの治療 |
2型(若年性)ヘモクロマトーシスでは早期から鉄沈着が進行するため、より積極的な治療が求められることがあるでしょう。
一方 4型(フェロポルチン病)ではマクロファージからの鉄放出異常があるため瀉血療法により貧血が悪化しやすいという特徴があります。
これらの病型の特性を考慮して個々の患者さんに応じた治療方針を立てることが重要です。
治療効果のモニタリングと長期管理
遺伝性ヘモクロマトーシスの治療効果を評価するためには定期的なモニタリングが必要不可欠です。
主なモニタリング項目には以下のようなものがあります。
- 血清フェリチン値
- トランスフェリン飽和度
- 肝機能検査
- 心機能検査
これらの検査結果に基づいて治療の強度や頻度を調整していきます。
治療目標としては血清フェリチン値を50〜100ng/mL程度に維持することが一般的です。
この目標値に到達するまでの期間は 個々の患者さんの状態により異なりますが、多くの場合 数ヶ月から1〜2年程度を要します。
合併症に対する補助的治療
遺伝性ヘモクロマトーシスによる臓器障害に対しては鉄排出療法と並行して各種の補助的治療が行われることがあります。
主な補助的治療は以下のようなものです。
| 合併症 | 補助的治療 |
| 糖尿病 | 血糖コントロール |
| 心不全 | 心不全治療薬 |
| 関節症 | 疼痛管理 |
これらの補助的治療は患者さんのQOL向上や長期的な予後改善に大切な役割を果たします。
ただし補助的治療の必要性や内容は個々の患者さんの状態に応じて判断されます。
生活習慣の調整と長期的な管理
遺伝性ヘモクロマトーシスの治療においては医学的介入だけでなく患者さん自身による生活習慣の調整も重要です。
推奨される生活習慣の調整には以下のようなものがあります。
- アルコール摂取の制限
- ビタミンC摂取量の調整
- 鉄分強化食品の摂取制限
これらの生活習慣の調整は治療効果を最大化し、長期的な健康維持に寄与する可能性が広がるでしょう。
治療開始後も定期的な医療機関の受診と生活習慣の継続的な管理が必要です。
遺伝性ヘモクロマトーシスは完全な治癒が難しい慢性疾患ですが 適切な治療と管理によって多くの患者さんが良好なQOLを維持できることが知られています。
長期的な視点に立った継続的な管理が遺伝性ヘモクロマトーシス患者さんの健康維持には不可欠です。

治療に伴う副作用とリスク
瀉血療法に関連する副作用
遺伝性ヘモクロマトーシスの主要な治療法である瀉血療法には いくつかの副作用やリスクが伴う可能性があります。
瀉血療法に関連する主な副作用には以下のようなものがあります。
- 貧血
- めまいや立ちくらみ
- 倦怠感
- 血管迷走神経反射
これらの副作用は 一般的に一時的なものですが 患者さんのQOLに影響を与えることがあります。
特に治療初期や高齢の患者さんでは 副作用が顕著に現れやすいという特徴があります。
| 副作用 | 発生頻度 |
| 貧血 | 高頻度 |
| めまい | 中程度 |
| 倦怠感 | 高頻度 |
| 血管迷走神経反射 | 低頻度 |
貧血は瀉血療法に伴う最も一般的な副作用であり、特に治療初期に顕著に現れることがあります。
貧血が進行すると日常生活に支障をきたす可能性があるため慎重なモニタリングが必要です。
キレート療法の副作用とリスク
瀉血療法が困難な患者さんに対して行われるキレート療法にもいくつかの副作用やリスクが存在します。
キレート療法に用いられる薬剤の主な副作用は以下の通りです。
| 薬剤 | 主な副作用 |
| デフェロキサミン | 注射部位反応 聴覚障害 |
| デフェラシロクス | 消化器症状 腎機能障害 |
これらの副作用は薬剤の投与量や投与期間 患者さんの個体差によって発現の程度が異なります。
特に長期使用時には定期的な副作用のモニタリングが重要です。
またキレート療法では過剰な鉄除去による亜鉛やその他の微量元素の欠乏が生じる可能性があることも留意すべきです。
治療に伴う心理的負担
遺伝性ヘモクロマトーシスの治療は長期にわたるため患者さんに心理的な負担をもたらすことがあります。
治療に伴う心理的な影響は以下のようなものです。
- 治療の長期継続に対する不安
- 頻繁な通院による日常生活への支障
- 疾患や治療に対する社会的偏見への懸念
これらの心理的負担は治療のアドヒアランスに影響を与える可能性があるため医療者側の適切なサポートが必要です。
特に若年発症の2型ヘモクロマトーシス患者さんでは生涯にわたる治療の必要性が大きな心理的ストレスとなることがあります。
合併症に対する治療のリスク
遺伝性ヘモクロマトーシスに伴う合併症に対する治療にもそれぞれ固有のリスクが存在します。
主な合併症治療とそのリスクは以下の通りです。
| 合併症 | 治療 | 主なリスク |
| 肝硬変 | 肝移植 | 拒絶反応 感染症 |
| 糖尿病 | インスリン療法 | 低血糖 |
| 心不全 | 心不全治療薬 | 腎機能障害 電解質異常 |
これらの合併症治療は遺伝性ヘモクロマトーシスの管理において必要不可欠なものですが、それぞれのリスクを十分に考慮した上で実施する必要があります。
特に肝移植は重度の肝硬変を伴う遺伝性ヘモクロマトーシス患者さんの治療選択肢となることがありますが、手術に伴う重大なリスクがあることを認識しておくことが重要です。
治療中断のリスク
遺伝性ヘモクロマトーシスの治療を中断した場合 体内の鉄蓄積が再び進行するリスクがあります。
以下は治療中断に伴う主なリスクです。
- 臓器障害の進行
- 合併症の悪化
- 生命予後への影響
これらのリスクは治療中断の期間や患者さんの状態によって異なりますが、一般的に治療の継続が推奨されます。
特に1型および3型ヘモクロマトーシスでは治療中断後の鉄蓄積の進行が比較的緩やかであるのに対し、2型(若年性)ヘモクロマトーシスでは急速な鉄蓄積が生じる可能性があるのです。
遺伝的影響と家族への配慮
遺伝性ヘモクロマトーシスの診断と治療は 患者さん本人だけでなく家族にも影響を与える可能性があります。
遺伝的影響に関連する配慮すべき事項は以下のようなものです。
- 家族の遺伝子検査の必要性
- 遺伝情報の開示に伴う心理的負担
- 家族計画への影響
これらの問題に対しては遺伝カウンセリングなどの専門的なサポートが重要です。
特に1型ヘモクロマトーシスは常染色体劣性遺伝形式をとるため患者さんの子どもが保因者となる可能性が高いことに留意しなければなりません。
遺伝性ヘモクロマトーシスの治療に伴う副作用やリスクを理解して適切に管理することは患者さんのQOL維持と長期的な予後改善にとって大切です。
医療者と患者さんが密接に連携して個々の状況に応じた最適な治療アプローチを選択することが副作用やリスクの最小化につながる可能性があります。

再発リスクと予防戦略
再発の定義と特徴
遺伝性ヘモクロマトーシスにおける「再発」は一度改善した鉄過剰状態が再び悪化することを指します。
この疾患は遺伝子変異に基づく慢性的な代謝異常であるため、完全な治癒は困難であり生涯にわたる管理が必要です。
再発のリスクは病型や個人の状態によって異なりますが、一般的に以下のような特徴があります。
| 病型 | 再発リスクの特徴 |
| 1型 | 緩やかな鉄蓄積再開 |
| 2型 | 比較的早い鉄蓄積再開 |
| 3型 | 1型に類似 |
| 4型 | 個人差が大きい |
2型(若年性)ヘモクロマトーシスでは他の型に比べて再発のリスクが高く、より慎重な経過観察が求められるケースがあります。
再発のリスク要因
遺伝性ヘモクロマトーシスの再発リスクに影響を与える要因にはさまざまなものがあります。
その主なリスク要因は以下のようなものです。
- 治療の中断や不規則な実施
- 過剰な鉄分摂取
- アルコールの過剰摂取
- 肝炎ウイルス感染
このような要因が単独で、または複合的に作用することで体内の鉄バランスが崩れて再び鉄過剰状態に陥る可能性があります。
特に治療の中断は最も重大なリスク要因の一つであり、長期的な予後に大きな影響を与える可能性があるでしょう。
定期的なモニタリングの重要性
遺伝性ヘモクロマトーシスの再発を早期に発見し、予防するためには定期的なモニタリングが不可欠です。
モニタリングの主な項目とその目的は以下の通りです。
| 検査項目 | 目的 |
| 血清フェリチン | 体内鉄貯蔵量の評価 |
| トランスフェリン飽和度 | 鉄代謝状態の評価 |
| 肝機能検査 | 肝障害の有無確認 |
| 心機能検査 | 心臓への影響評価 |
これらの検査を定期的に実施することで鉄過剰状態の再発を早期に検出し、適切な対応を取ることが可能となります。
モニタリングの頻度は患者さんの状態や病型によって個別に設定されますが、一般的に3〜6ヶ月ごとの実施が推奨されることが多いです。
生活習慣の調整による再発予防
遺伝性ヘモクロマトーシスの再発予防において患者さん自身による生活習慣の調整は大切な役割を果たします。
再発予防に効果的な生活習慣の調整は次の通りです。
- 鉄分摂取量の適正化
- アルコール摂取の制限
- ビタミンCサプリメントの過剰摂取を避ける
- 定期的な運動の実施
上記のような生活習慣の調整は体内の鉄バランスの維持に寄与し、再発リスクの低減につながる可能性があります。
特に鉄分摂取量の調整は重要で、以下のような食品の過剰摂取を避けることが推奨されます。
- 赤身肉
- レバーなどの内臓肉
- 鉄分強化食品
ただし極端な食事制限は栄養バランスの崩れを招く可能性があるため医療従事者の指導のもと 適切な食事管理を行うことが望ましいです。
家族のスクリーニングと遺伝カウンセリング
遺伝性ヘモクロマトーシスは遺伝性疾患であるため、患者さんの家族も発症リスクを有している可能性があります。
家族の健康管理と再発予防の観点から次のような取り組みが重要です。
- 一親等の親族に対する遺伝子検査の推奨
- 遺伝カウンセリングの実施
- 家族全体での健康意識の向上
このような取り組みによって家族内での早期発見や予防的介入が可能となり、ひいては患者さん本人の再発予防にも寄与する可能性があります。
特に1型ヘモクロマトーシスでは常染色体劣性遺伝形式をとるため、患者さんの子どもが保因者である確率が高いことに留意しなければなりません。
ストレス管理と心理的サポート
遺伝性ヘモクロマトーシスの管理において精神的なストレスも再発のリスク要因となる可能性があります。
ストレス管理と心理的サポートの重要性は以下の点です。
| 側面 | 影響 |
| 免疫機能 | ストレスによる低下 |
| アドヒアランス | 心理状態による変動 |
| QOL | 全体的な生活の質 |
これらの側面に配慮し 適切なストレス管理と心理的サポートを行うことで 再発リスクの低減につながる可能性があります。
必要に応じて心理カウンセリングや支援グループへの参加も検討される場合もあるでしょう。

遺伝性ヘモクロマトーシスの治療費
遺伝性ヘモクロマトーシスの治療費は長期的な管理が必要なため高額になる可能性があります。
初診料や検査費用、定期的な瀉血療法の費用、合併症に対する治療費など様々な要素が含まれます。
公的医療保険や高額療養費制度の利用で患者負担を軽減できますが、それでも経済的負担は大きいことがあります。
初診・再診料と検査費用
初診料は2,910円~5,410円、再診料は750円~2,660円です。
血液検査費用は1回あたり5,000円から10,000円程度かかることがあります。
瀉血療法の費用
瀉血療法は1回あたり2,500円です。頻度によっては月に10,000円以上の負担になる可能性があります。
| 項目 | 費用 |
| 初診料 | 2,910円~5,410円 |
| 再診料 | 750円~2,660円 |
| 血液検査 | 4,200円(血液一般+生化学5-7項目の場合) +110円(鉄) |
| 瀉血療法 | 2,500円/回 |
合併症治療の追加費用
肝臓や心臓の合併症治療には追加の検査や薬剤費用が発生します。
MRI検査は1回19,000円~30,200円以上、専門的な薬剤治療は月に数万円の負担となることもあります。
経済的支援制度
高額療養費制度の活用により、自己負担額の上限が設定される場合があります。
また、民間の医療保険や生命保険の活用も経済的負担軽減に役立つ可能性があります。
| 支援制度 | 概要 |
| 高額療養費制度 | 自己負担上限額の設定 |
| 民間医療保険 | 入院・手術費用の補償 |
| 生命保険 | 特定疾病保障特約の利用 |
なお、上記の価格は2024年11月時点のものであり、最新の価格については随時ご確認ください。
以上