代謝疾患の一種である脂肪酸代謝異常症(FAOD)とは、体内で脂肪からエネルギーを作り出す過程に問題が生じる遺伝性の病気のことです。
この疾患では、脂肪酸を分解する酵素の働きが不十分なため、体がエネルギーを効率よく作り出せません。
そのため、長時間の絶食や激しい運動、発熱などのストレス状況下で、体に必要なエネルギーが不足してしまう可能性があります。
症状は個人差が大きく、軽度なものから重度なものまで様々です。早期発見と適切な対応が重要となります。
脂肪酸代謝異常症の主症状について
脂肪酸代謝異常症(FAOD)の主症状は、エネルギー不足による様々な体の不調として現れ、患者さんの日常生活に大きな影響を与えることがあります。
この疾患(しっかん)では、体が脂肪を効率的にエネルギーに変換できないため、患者さんは日常生活で多くの症状を経験する可能性があり、その程度や頻度は個人によって異なることがわかっています。
エネルギー不足による全身症状
FAODの患者さんは、体がエネルギーを十分に作り出せないことから、全身にわたる症状を呈することがあり、特に長時間の絶食や激しい運動後に顕著になることが多いとされています。
これらの症状は、患者さんの生活の質を著しく低下させる可能性があるため、早期の認識と適切な対応が求められます。
| 症状 | 特徴 | 影響 |
| 倦怠感 | 慢性的な疲労感 | 日常活動の制限 |
| 筋力低下 | 筋肉の弱さや痛み | 運動能力の低下 |
| 発汗異常 | 多汗または寒気 | 体温調節の乱れ |
| めまい | 立ちくらみや失神 | 転倒リスクの増加 |
これらの症状は、体内のエネルギー不足が原因で起こり、患者さんによっては、日常生活に支障をきたすほどの強い症状を経験することもあります。
そのため、症状の程度や頻度を注意深く観察し、必要に応じて医療専門家に相談することが重要となります。
代謝性アシドーシスと関連症状
FAODでは、体内に脂肪酸が蓄積することで代謝性アシドーシスという状態に陥ることがあり、これは血液が酸性に傾くことを意味し、様々な症状を引き起こす要因となります。
代謝性アシドーシスは、患者さんの全身に影響を及ぼし、緊急の医療介入が必要となる場合もあるため、その症状を理解し、早期に対応することが極めて重要です。
- 呼吸が速くなる(過呼吸)
- 吐き気や嘔吐
- 腹痛
- 意識レベルの低下
- 脱水症状
- 不整脈
代謝性アシドーシスは重大な合併症につながる可能性があるため、早期発見と対応が重要です。患者さんやご家族は、これらの症状が現れた場合、速やかに医療機関を受診することが求められます。
低血糖症状
FAODの患者さんは、体がグルコースを効率的に利用できないため、低血糖に陥りやすい傾向があり、特に空腹時や運動後に起こりやすいことが知られています。低血糖は患者さんの日常生活に大きな影響を与え、適切な管理が必要となります。
| 低血糖症状 | 説明 | 対処法 |
| 冷や汗 | 急激な発汗 | 糖分の摂取 |
| 動悸 | 心拍数の上昇 | 安静にする |
| 手の震え | 不随意な振戦 | 血糖値の測定 |
| 集中力低下 | 思考力の減退 | 医療機関への相談 |
これらの症状は、体内のグルコース濃度が低下することで引き起こされます。低血糖が進行すると、意識障害や昏睡に至る場合もあるため注意が必要です。
患者さんとそのご家族は、低血糖の兆候を早期に認識し、適切な対応を取れるよう準備しておくことが大切です。
筋肉症状と運動耐容能の低下
FAODでは、筋肉組織におけるエネルギー産生に問題が生じるため特徴的な筋肉症状が現れることがあり、これらの症状は患者さんの日常生活や運動能力に大きな影響を与える可能性があります。
筋肉症状は、FAODの診断や経過観察において重要な指標となることがあります。
- 筋肉痛
- 筋力低下
- 運動時の早期疲労
- クレアチンキナーゼ(CK)値の上昇
- 筋萎縮
- 筋硬直
また、運動耐容能の低下も顕著な症状の一つです。
患者さんは通常の運動や身体活動でも疲労を感じやすく回復に時間がかかることがあります。この運動耐容能の低下は、患者さんの生活の質に大きな影響を与える可能性があるため、適切な運動管理と日常生活の調整が必要となります。
| 運動関連症状 | 詳細 | 日常生活への影響 |
| 易疲労性 | 少しの活動でも疲れやすい | 日常タスクの遂行困難 |
| 筋痙攣 | 運動中や運動後の筋肉のけいれん | 運動の制限 |
| 横紋筋融解症 | 重度の筋肉障害 | 緊急医療の必要性 |
| 回復遅延 | 運動後の回復に通常以上の時間を要する | 活動スケジュールの調整 |
これらの症状は、FAODにおける筋肉でのエネルギー代謝異常を反映しています。
患者さんの生活の質に大きな影響を与える可能性があるため適切な運動管理が欠かせません。医療専門家と相談しながら、個々の患者さんに適した運動プログラムや日常生活の調整を行うことが重要です。
FAODの原因
脂肪酸代謝異常症(FAOD)は、遺伝子の変異によって引き起こされる先天性代謝異常症の一群であり、体内で脂肪酸を効率的にエネルギーに変換するプロセスに問題が生じることで発症する複雑な代謝疾患です。
この疾患は、患者さんの生活の質に大きな影響を与える可能性があるため、その原因とメカニズムを深く理解することが重要となります。
遺伝子変異と酵素の機能不全
FAODの主な原因は、ミトコンドリアでの脂肪酸β酸化に関与する酵素をコードする遺伝子の変異にあり、この変異により必要な酵素が正常に機能しないか、十分な量が産生されないといった事態が起こることで脂肪酸の代謝に支障をきたします。
遺伝子変異の種類や位置によって、影響を受ける酵素や代謝経路が異なりFAODの多様な臨床像につながっています。
| 遺伝子 | 関連酵素 | 影響を受ける代謝過程 | 遺伝形式 |
| ACADM | MCAD | 中鎖脂肪酸の代謝 | 常染色体劣性 |
| HADHA | LCHAD | 長鎖脂肪酸の代謝 | 常染色体劣性 |
| CPT2 | CPT II | カルニチンサイクル | 常染色体劣性 |
| SLC25A20 | CACT | カルニチン輸送 | 常染色体劣性 |
これらの遺伝子変異は常染色体劣性遺伝形式で受け継がれるため、両親から変異遺伝子を1つずつ受け継いだ場合に発症します。
このような遺伝形式は、FAODが家族性に発症する可能性があることを示唆しており、家族歴の詳細な聴取が診断の手がかりとなることがあります。
脂肪酸代謝経路の障害
FAODでは、脂肪酸がミトコンドリア内で適切に代謝されないことが問題の核心であり、この代謝障害は体のエネルギー産生システム全体に影響を及ぼす可能性があります。
正常な脂肪酸代謝は以下のステップを経て行われますが、FAODではこれらのプロセスのいずれかに問題が生じています。
- 脂肪酸の活性化
- カルニチンとの結合
- ミトコンドリア内膜の通過
- β酸化による分解
- エネルギー産生
これらのいずれかのステップに障害があると脂肪酸からのエネルギー産生が滞り、FAODの症状につながります。
特に長時間の絶食や運動などのストレス状況下ではこの代謝障害がより顕著になり、深刻な健康問題を引き起こす可能性があります。
環境因子とトリガー
遺伝子変異が基盤にありますが、FAODの症状が顕在化するきっかけには環境因子が関与することがあり、これらの因子は体内のエネルギー需要と供給のバランスを崩す要因となり、潜在的な代謝異常を顕在化させる可能性があります。
環境因子の影響を理解することはFAODの管理において極めて重要です。
| 環境因子 | 影響 | リスク | 予防策 |
| 長時間の絶食 | グリコーゲン枯渇 | 高い | 規則正しい食事摂取 |
| 激しい運動 | エネルギー消費増大 | 中程度 | 適度な運動管理 |
| 感染症 | 代謝亢進 | 高い | 早期の医療介入 |
| 寒冷暴露 | 体温維持のエネルギー消費 | 低い | 適切な防寒対策 |
これらの因子は、体がエネルギー源として脂肪酸に依存せざるを得ない状況を作り出し、FAODの患者さんでは代謝の破綻を引き起こす可能性があります。
環境因子の影響を最小限に抑えるための生活指導や予防策がFAODの管理において重要な役割を果たします。
ミトコンドリア機能と代謝のバランス
FAODにおいては、ミトコンドリアでの脂肪酸代謝の障害が中心的な役割を果たし、このミトコンドリア機能の異常は細胞全体のエネルギー代謝に広範な影響を及ぼす可能性があります。
ミトコンドリアは細胞のエネルギー工場と呼ばれ、脂肪酸やグルコースからATPを産生する重要な役割を担っていますが、FAODではこの機能が著しく損なわれています。
| ミトコンドリアの機能 | FAODでの影響 | 潜在的な結果 |
| 脂肪酸β酸化 | 効率低下 | エネルギー不足 |
| ATP産生 | 減少 | 細胞機能の低下 |
| 活性酸素種の処理 | 不十分 | 酸化ストレスの増加 |
| カルニチンサイクル | 障害 | 脂肪酸の蓄積 |
FAODではこれらのミトコンドリア機能の一部または複数が障害されることで、エネルギー産生の効率が低下し代謝のバランスが崩れます。
この代謝バランスの乱れはFAODの多様な臨床症状の根底にある要因となっています。
二次的な代謝異常
FAODの原因となる一次的な酵素欠損に加え二次的な代謝異常が生じることがあり、これらの二次的な異常はFAODの複雑な病態生理を形成する要因となり、診断や治療をより困難にする可能性があります。
二次的な代謝異常の理解はFAODの包括的な管理において重要な役割を果たします。
| ケトン体産生の低下 | エネルギー源としてのケトン体が不足 |
| 糖新生の障害 | 低血糖のリスクが増加 |
| アンモニア代謝の乱れ | 高アンモニア血症の可能性 |
| カルニチン欠乏 | 脂肪酸の輸送に影響 |
これらの二次的な代謝異常はFAODの症状を多様化させ診断をより複雑にする可能性があります。
各患者さんの個別の代謝プロファイルを詳細に評価し適切な管理戦略を立てることが重要です。
FAODの原因は主に遺伝子変異にありますが、その発症や重症度には様々な要因が関与し遺伝子変異の種類や環境因子、個人の代謝特性など、複数の要素が複雑に絡み合って病態を形成することが明らかになっています。
この複雑性が、FAODの診断や管理を困難にする一因となっています。
診察と診断
脂肪酸代謝異常症(FAOD)の診断は複数のステップを経て慎重に進められる必要があり、患者さんの症状や家族歴の詳細な聴取から始まり生化学的検査、遺伝子解析まで多岐にわたる総合的なアプローチが求められます。
この疾患の診断プロセスは早期発見と適切な管理につながる重要な過程であり、専門医による綿密な評価が不可欠です。
初診時の問診と身体診察
FAODの診断において初診時の問診は極めて重要な役割を果たし、医師は患者さんやご家族から詳細な情報を収集しFAODを疑うきっかけとなる兆候を探ります。
この段階で得られた情報はその後の診断プロセスの方向性を決定する重要な基盤となります。
| 問診項目 | 確認ポイント | 診断的意義 |
| 家族歴 | 類似症状や早期死亡の有無 | 遺伝性疾患の可能性を示唆 |
| 発達歴 | 成長や運動発達の遅れ | 代謝異常の影響を評価 |
| 食事習慣 | 絶食の頻度や長さ | 代謝ストレスの程度を推定 |
| 運動耐容能 | 疲れやすさや筋力低下 | エネルギー代謝障害の指標 |
身体診察ではFAODに特徴的な身体所見を注意深く観察します。
肝腫大や筋力低下、心臓の異常など様々な兆候を見逃さないよう丁寧な診察が行われ、これらの所見は、FAODの存在を示唆する重要な手がかりとなります。
生化学的検査
FAODの診断において生化学的検査は中心的な役割を果たし、血液や尿を用いた各種検査により代謝異常の有無や程度を評価します。
これらの検査結果はFAODの診断精度を高め、さらに具体的な酵素欠損の種類を推定する上で重要な情報源となります。
| 血中アシルカルニチン分析 | 特定の脂肪酸代謝中間体の蓄積を検出 |
| 尿中有機酸分析 | 代謝異常に特徴的な有機酸の排泄パターンを評価 |
| 血糖値測定 | 低血糖の有無と程度を確認 |
| 肝機能検査 | 肝臓への影響を評価 |
| クレアチンキナーゼ(CK)値測定 | 筋肉障害の程度を判断 |
これらの検査結果は、FAODの診断だけでなく、その重症度や具体的な酵素欠損の種類を推定する手がかりとなり、その後の治療方針の決定にも重要な影響を与えます。
新生児マススクリーニング
多くの国や地域ではFAODを含む先天性代謝異常症の早期発見を目的とした新生児マススクリーニングが実施されており、これは生後数日以内に採取された血液サンプルを用いて、特定の代謝物質の異常を検出する検査です。
この検査は症状が現れる前にFAODを発見し、早期介入の機会を提供する可能性があるため公衆衛生上重要な役割を果たしています。
| スクリーニング項目 | 検出対象 | カットオフ値 | 偽陽性率 |
| アシルカルニチン | 中鎖アシルCoA脱水素酵素欠損症 | >0.5 μmol/L | <0.1% |
| C14:1アシルカルニチン | 極長鎖アシルCoA脱水素酵素欠損症 | >0.4 μmol/L | <0.05% |
| C0(遊離カルニチン) | カルニチン欠乏症 | <10 μmol/L | <0.2% |
| C16アシルカルニチン | カルニチンパルミトイルトランスフェラーゼ欠損症 | >7 μmol/L | <0.1% |
新生児マススクリーニングは、FAODの早期発見と介入を可能にし、患者さんの予後改善に大きく貢献する可能性があります。
遺伝子解析
FAODの確定診断には遺伝子解析が不可欠であり、特定の遺伝子に変異が見つかればFAODの診断が確定し、さらに具体的な酵素欠損の種類も特定されます。
この解析結果は患者さんの長期的な管理計画の立案や遺伝カウンセリングにおいても重要な情報源となります。
| 解析対象遺伝子 | 関連するFAOD | 変異の種類 | 遺伝形式 |
| ACADM | 中鎖アシルCoA脱水素酵素欠損症 | ミスセンス変異 | 常染色体劣性 |
| HADHA | 長鎖3-ヒドロキシアシルCoA脱水素酵素欠損症 | フレームシフト変異 | 常染色体劣性 |
| CPT2 | カルニチンパルミトイルトランスフェラーゼII欠損症 | スプライシング変異 | 常染色体劣性 |
| SLC25A20 | カルニチン-アシルカルニチントランスロカーゼ欠損症 | ナンセンス変異 | 常染色体劣性 |
遺伝子解析の結果は患者さんの予後予測や遺伝カウンセリングにも活用され、家族計画や将来の健康管理に関する重要な情報を提供します。
負荷試験と機能検査
一部のFAOD症例では診断を確定するために負荷試験や機能検査が必要となることがあり、これらの検査は、患者さんの体が特定の状況下でどのように反応するかを評価するものです。
これらの検査は慎重に管理された環境下で行われ、患者さんの安全を最優先に考慮しながら実施されます。
| 絶食試験 | 体が飢餓状態にどう対応するかを観察し、代謝適応能力を評価します。 |
| 運動負荷試験 | 筋肉でのエネルギー代謝を評価し、運動時の代謝応答を分析します。 |
| 脂肪負荷試験 | 脂肪酸代謝能力を直接評価し、特定の酵素欠損を確認します。 |
| 安定同位体トレーサー試験 | 特定の脂肪酸の代謝経路を詳細に追跡します。 |
これらの検査は、FAODの診断精度を高め、個々の患者さんの代謝特性をより詳細に理解するのに役立ちます。
脂肪酸代謝異常症の画像所見とその特徴
脂肪酸代謝異常症(FAOD)の画像所見は、この疾患の診断や経過観察において重要な役割を果たしFAODの影響が全身に及ぶため、様々な臓器や組織に特徴的な変化が見られることがあります。
これらの変化を適切な画像検査で捉えることが診断の一助となり患者さんの状態を非侵襲的に評価することができます。
肝臓の画像所見
FAODにおいて肝臓は代謝異常の影響を受けやすい臓器の一つであり、肝臓の画像検査では以下のような所見が観察されることがあります。
これらの所見はFAODによる肝臓への脂肪蓄積や代謝異常を反映していますが、他の肝疾患でも見られるためFAODに特異的ではありません。
| 画像検査 | 主な所見 | 特徴 | 臨床的意義 |
| 超音波検査 | 肝腫大、脂肪肝 | エコー輝度の上昇 | 脂肪蓄積の評価 |
| CT検査 | 肝臓の密度低下 | 脂肪沈着を示唆 | 肝実質の変化を定量化 |
| MRI検査 | T1強調像での信号上昇 | 脂肪蓄積を反映 | 脂肪含有量の精密評価 |
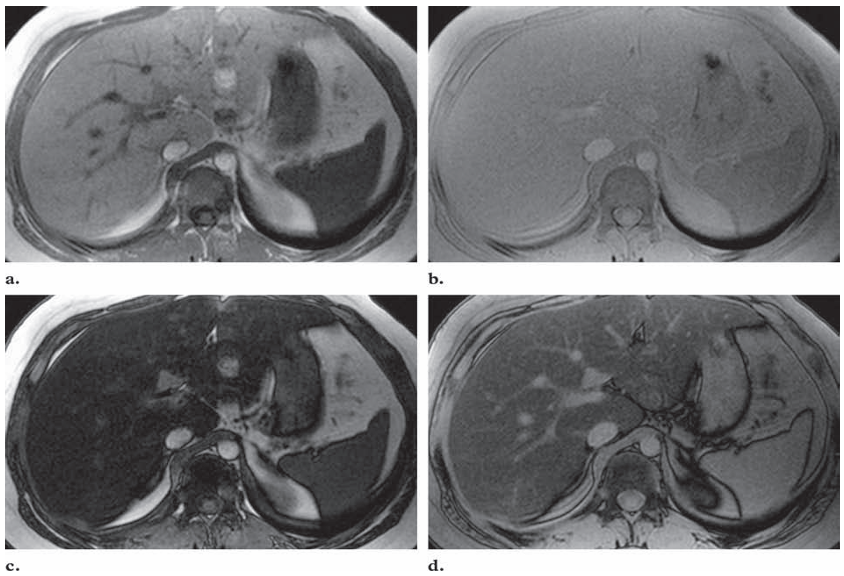
所見:(a, b) In phase MR画像では、皮下脂肪組織、内臓脂肪組織、および脂肪肝が、heavy T1WIの(a)では脾臓に対してより高い信号強度を示し、最小限のT1強調(フリップアングル=15°)の(b)ではあまり高信号ではない。(c, d)Out-of-phase MR画像では、脂肪肝(水優勢組織)の信号低下が強いT1強調(c)では顕著で、推定脂肪率が高くなる一方で、最小限のT1強調(d)ではそれほどでないことを示している。対照的に、皮下および内臓脂肪組織(脂肪優勢組織)の信号損失は最小限のT1強調でより大きい。
心臓の画像所見
FAODは心筋にも影響を及ぼすことがあり心臓の画像検査で特徴的な所見が見られることがあります。
これらの所見はFAODによる心筋でのエネルギー代謝異常や脂肪蓄積を反映しており、心臓の画像所見は、FAODの心臓への影響を評価する上で重要な情報を提供します。
| 心エコー検査での心筋肥大や心機能低下 | 心室壁の肥厚や収縮能の低下が観察されることがあります |
| 心臓MRIでの心筋の信号強度変化 | T1強調像での信号上昇が脂肪蓄積を示唆することがあります |
| 心筋シンチグラフィーでの代謝異常パターン | 脂肪酸代謝トレーサーの取り込み異常が見られることがあります |
| 冠動脈CTでの脂肪沈着所見 | 冠動脈壁への脂肪沈着が観察されることがあります |

所見:局所化プロトン磁気共鳴分光法(1H-MRS)による心筋の評価。化学シフトによるクレアチンのボクセル(白いボックス)が設定されたボクセル(オーカー色のボックス)は、AおよびBの中隔に位置し、シムボリューム(緑のボックス)に囲まれている。水抑制シングルボクセルポイント解像分光法(PRESS)を使用して、1H-MRスペクトルCが取得され、心筋脂質含量Dおよび総クレアチン含量を推定する。CPT2D、カルニチンパルミトイルトランスフェラーゼII欠損症;LCHADD、長鎖3-ヒドロキシアシル-CoAデヒドロゲナーゼ欠損症;VLCADD、超長鎖アシル-CoAデヒドロゲナーゼ欠損症。
骨格筋の画像所見
FAODは骨格筋にも影響を与え特徴的な画像所見が観察されることがあります。
これらの所見はFAODによる骨格筋の代謝異常や構造変化を反映しており、診断や経過観察に有用な情報を提供します。
| 画像検査 | 所見 | 意義 | 評価ポイント |
| MRI T1強調像 | 信号強度上昇 | 脂肪浸潤を示唆 | 筋肉内脂肪の分布 |
| MRI T2強調像 | 信号強度上昇 | 浮腫や炎症を反映 | 急性期の変化を評価 |
| 筋CT | 筋密度低下 | 脂肪変性を示唆 | 筋量と質的変化 |
| PETスキャン | 代謝活性の低下 | エネルギー代謝異常を反映 | 機能的な代謝評価 |
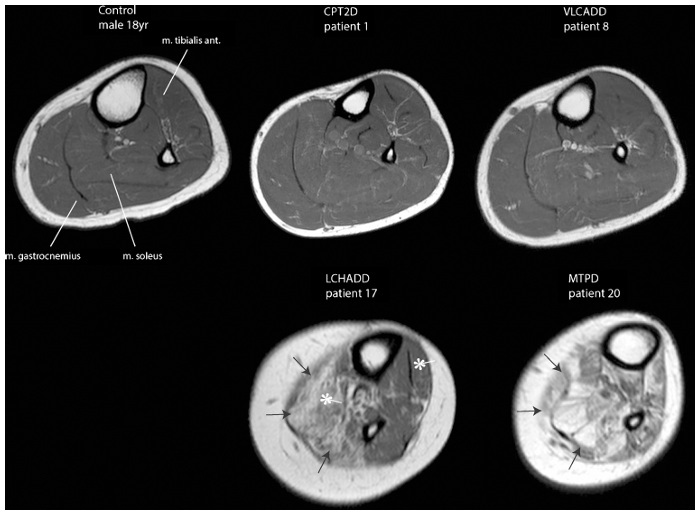
所見:『左下腿のT1強調画像』。対照およびCPT2D、VLCADD、LCHADD、およびMTPD患者における左下腿のT1強調横断画像。黒い矢印は、筋肉内の高信号強度(LCHADDおよびMTPD)を示している。アスタリスクは、腓腹筋(m. gastrocnemius)と前脛骨筋(m. tibialis)間の信号強度の違い(脂肪の多さの違い)を強調している。
脳の画像所見
FAODは中枢神経系にも影響を及ぼすことがあり脳の画像検査で特徴的な所見が観察されることがあります。これらの所見は、
FAODによる脳のエネルギー代謝異常や神経細胞への影響を反映しており、FAODの神経学的合併症の評価に重要です。
| MRIでの白質異常信号 | T2強調像やFLAIR像で高信号域として観察されることがあります |
| 基底核や視床の信号変化 | T1強調像での低信号や T2強調像での高信号が見られることがあります |
| 脳萎縮所見 | 皮質や皮質下構造の萎縮が進行性に観察されることがあります |
| MRスペクトロスコピーでの代謝物質の異常パターン | N-アセチルアスパラギン酸の減少やLactateの上昇が見られることがあります |
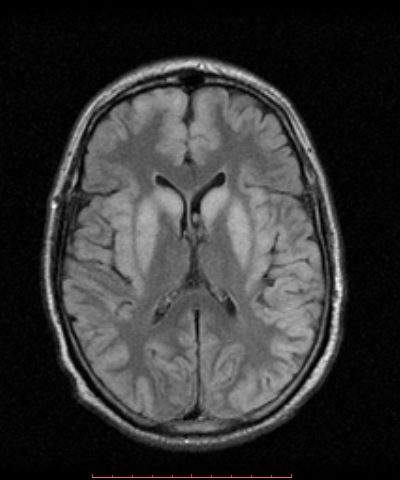
所見:低血糖脳症の症例。皮質、尾状核、淡蒼球および被殻にびまん性の高信号域を認める。視床、小脳および視床下部には損傷がないことに注意する。
全身の代謝活性評価
FAODの全身への影響を評価するためにPET/CTなどの機能的画像検査が用いられることがあります。
これらの検査はFAODによる全身の代謝異常を視覚化し定量的に評価することができ、治療効果のモニタリングにも有用です。
| 検査 | 評価対象 | 所見 | 臨床的意義 |
| FDG-PET | グルコース代謝 | 代謝活性の低下 | エネルギー利用効率の評価 |
| 脂肪酸PET | 脂肪酸代謝 | 取り込み異常 | 脂肪酸代謝経路の機能評価 |
| アセテートPET | ミトコンドリア機能 | 代謝回転の変化 | ミトコンドリア活性の定量 |
| 全身MRI | 脂肪分布 | 異所性脂肪沈着 | 全身の脂肪蓄積パターン評価 |
FAODの画像所見は多様であり疾患の重症度や病期によって異なる場合があります。
また、これらの所見はFAODに特異的なものではなく他の代謝疾患や一般的な疾患でも類似した所見が見られることがあるため慎重な解釈が求められます。

所見:患者の体脂肪分布:磁気共鳴画像(MRI)。(A) 患者1および2の腕、前腕、大腿、ふくらはぎ、および腹部のT1強調MRI軸位スキャンを、同年齢(35歳)およびBMI(23 kg/m²)の対照女性と比較。四肢の部分的な脂肪萎縮と、腹腔内脂肪の蓄積が両患者で確認された。患者1では、皮下腹部脂肪の増加も顕著であった。骨髄脂肪は良好に保たれていた。(B) 患者1および対照女性(BMI 21 kg/m²)の骨盤軸位T1強調MRIスキャンでは、患者1において臀部脂肪の萎縮と前腹部皮下脂肪の蓄積が見られた。
FAODの治療方法と薬、管理の期間
脂肪酸代謝異常症(FAOD)の治療は患者さんの生活の質を向上させ合併症のリスクを軽減することを目的としています。
この疾患は完治が困難なため長期的な管理が必要となります。
治療方針は個々の患者さんの状態や特定のFAODの種類によって異なりますが、一般的に食事療法、薬物療法そして緊急時の対応を組み合わせた包括的なアプローチが取られます。
食事療法
FAODの治療において食事療法は中心的な役割を果たします。食事療法の目的は体内での脂肪酸の蓄積を防ぎ適切なエネルギー供給を確保することです。
| 食事療法の要点 | 目的 | 実施上の注意点 |
| 低脂肪食 | 脂肪酸の蓄積を防ぐ | 必須脂肪酸の確保 |
| 高炭水化物食 | 代替エネルギー源の確保 | 血糖値の管理 |
| 中鎖脂肪酸(MCT)の活用 | エネルギー補給の効率化 | 消化器症状への配慮 |
| 頻回食 | 長時間の絶食を避ける | 夜間の食事管理 |
食事療法は栄養士の指導のもと個々の患者さんのニーズに合わせて調整されます。特に成長期の子どもの場合は適切な栄養摂取と成長のバランスを取ることが重要です。
薬物療法
FAODの治療には様々な薬剤が使用されます。これらの薬剤は不足している物質を補充したり代謝経路を補助したりする目的で使用されます。
- L-カルニチン補充療法 脂肪酸の細胞内輸送を促進
- リボフラビン(ビタミンB2)補充 酵素の補酵素として機能
- ベザフィブラート 脂肪酸代謝を促進
- グリセロール フェニルブチレート 代替経路でのアンモニア排出を促進
これらの薬剤は患者さんの状態や特定のFAODの種類に応じて選択され、副作用や相互作用にも注意が必要です。
緊急時の対応
FAODの患者さんは代謝クリーゼと呼ばれる急性増悪のリスクがあります。このような緊急時には迅速な対応が求められます。
| 緊急時の対応 | 目的 | 実施のタイミング |
| ブドウ糖輸液 | エネルギー供給の確保 | 症状発現直後 |
| 電解質補正 | 代謝性アシドーシスの是正 | 検査結果に応じて |
| L-カルニチン静注 | 毒性代謝物の排出促進 | 医師の指示に従い |
| 人工呼吸管理 | 呼吸不全時の支援 | 重症例で必要時 |
緊急時の対応プランは事前に主治医と相談して準備しておくことが大切です。患者さんとご家族は緊急時の症状や対応方法について十分な教育を受ける必要があります。
長期的な管理と経過観察
FAODは生涯にわたる管理が必要な疾患で定期的な医療機関の受診と検査が重要となります。
- 血液検査(アシルカルニチン分析肝機能検査など)
- 尿検査(有機酸分析)
- 心臓超音波検査
- 骨密度検査
- 神経学的評価
これらの検査結果に基づいて治療方針の微調整が行われます。また成長や加齢に伴う身体の変化に応じて食事療法や薬物療法の調整が必要となることもあります。
治癒までの期間
FAODは現時点で完治が困難な疾患であり「治癒までの期間」という概念はあまり適切ではありません。しかし適切な管理によって症状をコントロールし良好な生活の質を維持することが可能です。
| 管理の段階 | 目標 | 期間 | 主な介入 |
| 急性期 | 代謝安定化 | 数日〜数週間 | 集中治療 |
| 安定期 | 症状コントロール | 継続的 | 外来管理 |
| 長期管理 | 合併症予防 | 生涯 | 定期検査 |
| 移行期 | 成人期への移行 | 個別に設定 | 自己管理教育 |
FAODの管理は生涯続くものですが医学の進歩により患者さんの予後は年々改善しています。早期発見と適切な管理により多くの患者さんが健康的な生活を送ることができるようになっています。
治療の効果は個人差が大きく特定のFAODの種類や重症度によっても異なります。
一部の患者さんでは厳格な食事療法と薬物療法によりほぼ正常な生活を送ることができる場合もあります。一方でより頻繁な医療介入が必要な患者さんもいます。
治療の副作用やデメリット(リスク)
脂肪酸代謝異常症(FAOD)の治療は患者さんの生活の質を向上させる一方で様々な副作用やリスクを伴う可能性があり長期的な管理が必要となります。
これらの副作用やリスクは治療の種類や個々の患者さんの状態によって異なりますが医療チームと患者さん、そのご家族が十分に理解し適切に対処することが大切です。
食事療法に関連する副作用とリスク
FAODの治療では厳格な食事制限が必要となることがありますが、これには様々な課題が伴います。
| 食事療法の側面 | 潜在的なリスク | 対処法 |
| 低脂肪食 | 必須脂肪酸不足 | サプリメント補充 |
| 高炭水化物食 | 肥満、糖尿病 | 運動療法の併用 |
| 頻回食 | 社会生活への影響 | 生活スケジュールの調整 |
| MCT油の使用 | 消化器症状 | 段階的な導入 |
これらの食事制限は栄養バランスの偏りや成長障害につながる可能性があります。また厳格な食事管理は患者さんやご家族に大きな心理的負担をかけることがあります。
薬物療法の副作用
FAODの治療に用いられる薬剤にはそれぞれ特有の副作用があります。
- L-カルニチン
- 魚臭症候群
- 消化器症状(悪心嘔吐下痢)
- リボフラビン(ビタミンB2)
- 尿の黄色化
- 光過敏症
これらの副作用は一般に軽度ですが患者さんの生活の質に影響を与える可能性があります。
長期的な治療に伴うリスク
FAODの治療は生涯にわたって継続される必要があり、長期的な管理に伴う様々なリスクが存在します。
| 長期的なリスク | 影響を受ける側面 | 予防策 | モニタリング方法 |
| 心理社会的影響 | 自尊心、社会適応 | 心理サポート | 定期的な面談 |
| 経済的負担 | 家計、就労 | 社会福祉制度の活用 | 経済状況の確認 |
| 治療抵抗性 | 効果の減弱 | 定期的な治療法の見直し | 血液検査、症状観察 |
| 二次的合併症 | 骨密度低下、肝機能障害 | 予防的介入 | 定期的な検査 |
長期的な治療は患者さんの身体的健康だけでなく、心理的・社会的な側面にも影響を与える可能性があります。
緊急時の治療に関連するリスク
FAODの急性増悪時には緊急の治療介入が必要となることがありますが、これにも一定のリスクが伴います。
- 静脈内ブドウ糖投与
- 血糖値の急激な変動
- 電解質異常
- L-カルニチンの静脈内投与
- アレルギー反応
- 不整脈
緊急時の治療は生命を守るために不可欠ですがこれらのリスクについても認識しておく必要があります。
治療のモニタリングに伴うリスク
FAODの治療効果や副作用をモニタリングするために定期的な検査が必要となりますが、これにも一定のリスクが存在します。
| 検査項目 | 潜在的なリスク | 頻度 | 代替法の有無 |
| 血液検査 | 採血に伴う痛み、感染 | 1-3ヶ月毎 | 一部項目で唾液検査 |
| 画像検査 | 放射線被曝 | 年1-2回 | 超音波検査で代替可能な場合あり |
| 遺伝子検査 | 心理的影響、倫理的問題 | 診断時のみ | なし |
| 運動負荷試験 | 過度の疲労、代謝性危機 | 必要時 | 日常生活での観察で代替 |
これらの検査は治療管理に重要ですが患者さんに身体的・心理的負担をかける可能性があります。
FAODの治療に伴う副作用やリスクは個々の患者さんによって異なり全ての患者さんが全ての副作用を経験するわけではありません。しかしこれらの可能性を理解し適切に対処することが大切です。
再発の可能性と予防の仕方
脂肪酸代謝異常症(FAOD)は遺伝子変異に起因する慢性的な代謝疾患であり、完全な治癒は困難ですが適切な管理により症状の再発や悪化を防ぐことが可能であり、患者さんの生活の質を大きく向上させることができます。
FAODの再発リスクは個々の患者さんの状態や生活環境によって異なるため個別化された予防策が重要となり、医療チームと密接に連携しながら最適な管理方法を見出していく必要があります。
再発のリスク要因
FAODの再発や症状悪化には様々な要因が関与します。これらのリスク要因を理解し回避することが再発予防の第一歩となり、患者さんの日常生活における自己管理能力の向上につながります。
| リスク要因 | 影響 | 予防策 | 注意点 |
| 長時間の絶食 | エネルギー不足 | 規則正しい食事摂取 | 夜間の補食も考慮 |
| 過度の運動 | 代謝ストレス | 適度な運動管理 | 運動強度の調整 |
| 感染症 | 代謝亢進 | 予防接種感染予防 | 早期受診の重要性 |
| ストレス | ホルモンバランスの乱れ | ストレス管理技法の習得 | 定期的なストレスチェック |
これらのリスク要因は日常生活の中で遭遇する可能性が高いため常に注意が必要であり、患者さんとご家族の協力体制が重要となります。
食事管理による再発予防
FAODの再発予防において食事管理は中心的な役割を果たし、適切な栄養摂取と食事のタイミングに注意を払うことが大切です。個々の患者さんの metabolic な状態に合わせた細やかな調整が必要となります。
- 低脂肪高炭水化物食の維持:体内での脂肪酸代謝の負荷を軽減
- 必須脂肪酸の適切な摂取:成長と発達に必要な栄養素の確保
- 規則正しい食事時間の設定:代謝の安定化と急激な変動の回避
- 夜間の長時間絶食の回避:エネルギー不足状態の防止
これらの食事管理は栄養士の指導のもと個々の患者さんの状態に合わせて調整され、定期的な見直しと微調整が行われます。
運動と活動管理
FAODの患者さんにとって適度な運動は健康維持に重要ですが過度な運動は再発のリスクとなるため、慎重な活動管理が求められます。
運動の種類や強度、時間、頻度などを総合的に考慮し、個別化された運動プログラムを作成することが望ましいでしょう。
| 運動強度 | 推奨される活動 | 注意点 | 期待される効果 |
| 軽度 | ウォーキング散歩 | 水分補給 | 基礎代謝の向上 |
| 中度 | 水泳自転車 | 運動前後の食事 | 心肺機能の改善 |
| 高度 | 競技スポーツ | 医師との相談が必要 | 筋力増強柔軟性向上 |
運動の種類や強度は個々の患者さんの状態に応じて医療チームと相談の上決定し、定期的な評価と調整を行いながら、安全かつ効果的な運動習慣を確立していくことが重要です。
ストレス管理と心理的サポート
ストレスはFAODの再発や症状悪化のトリガーとなる可能性があり、効果的なストレス管理は再発予防に重要な役割を果たします。
患者さんの心理的な健康を維持することは、身体的な健康管理と同様に重要であり、総合的なアプローチが求められます。
| リラクセーション技法の習得 | 呼吸法、瞑想、ヨガなどの実践 |
| 十分な睡眠と休息 | 質の高い睡眠の確保と適切な休息時間の設定 |
| 社会的サポートの活用 | 家族、友人、患者会などのサポートネットワークの構築 |
| 必要に応じた心理カウンセリング | 専門家によるメンタルヘルスケアの提供 |
これらのストレス管理技法は患者さんの生活の質を向上させるだけでなく再発リスクの低減にも寄与し、長期的な疾患管理の成功につながります。
感染症予防と健康管理
感染症はFAODの患者さんにとって大きなリスク要因となるため、適切な感染予防策と健康管理が再発予防に重要です。日常生活における細やかな配慮と、必要に応じた医療介入の組み合わせが効果的です。
| 予防策 | 具体的な方法 | 効果 | 実施頻度 |
| 手洗い・うがい | 石鹸使用頻繁な実施 | 一般的な感染予防 | 毎日複数回 |
| 予防接種 | インフルエンザ肺炎球菌等 | 特定の感染症予防 | 年1回または必要時 |
| 体調管理 | 十分な睡眠バランスの取れた食事 | 免疫力の維持 | 継続的 |
| 定期健診 | 血液検査画像検査 | 早期の異常発見 | 3-6ヶ月ごと |
これらの予防策を日常生活に取り入れることで感染リスクを低減し再発予防につながり、患者さんの全体的な健康状態の維持向上に貢献します。
緊急時の対応準備
FAODの再発や急性増悪時に備えて緊急時の対応準備を整えておくことが重要です。万が一の状況に備えることで迅速かつ適切な対応が可能となり、重篤な合併症のリスクを軽減することができます。
| 緊急時用の食事プランの準備 | 速やかにエネルギーを補給できる食品の常備 |
| 携帯用の緊急カードの作成 | 患者情報と緊急連絡先、基本的な対応指示の記載 |
| 家族や周囲の人々への説明と協力要請 | 緊急時の対応手順の共有と理解 |
| 近隣の医療機関との連携体制の構築 | 専門医療機関との情報共有と受け入れ態勢の確認 |
これらの準備により再発時のリスクを最小限に抑えることが可能となり、患者さんとご家族の安心感にもつながります。
脂肪酸代謝異常症(FAOD)の治療費について
FAODの治療費は、患者の状態や必要な治療内容によって大きく異なります。検査費用や薬剤費が加わると高額になることがあります。入院が必要な場合、1日あたり30,000円以上かかる可能性があります。
検査費用
血液検査やMRI等の画像診断が必要な場合、検査費用が加算されます。
| 検査項目 | 概算費用 |
| 血液検査 | 4,200円(血液一般+生化学5-7項目の場合)+3,930円(脂肪酸分画) |
| MRI | 19,000円~30,200円 |
薬剤費
L-カルニチンなどの薬剤費は月額(エルカルチンFF錠250mg 180円/錠×6~12錠×30日=)32,400~64,800円です。
入院費用
症状が重い場合や精密検査が必要な際は入院が必要になることがあります。1日あたりの入院費用は30,000円以上かかる可能性があります。
詳しく説明すると、日本の入院費はDPC(診断群分類包括評価)システムを使用して計算されます。このシステムは、患者の病名や治療内容に基づいて入院費を決定する方法です。以前の「出来高」方式とは異なり、DPCシステムでは多くの診療行為が1日あたりの定額に含まれます。
DPCシステムの主な特徴
- 約1,400の診断群に分類される
- 1日あたりの定額制
- 一部の治療は従来通りの出来高計算が適用される
DPCシステムと出来高計算の比較表
| DPC(1日あたりの定額に含まれる項目) | 出来高計算項目 |
|---|---|
| 投薬 | 手術 |
| 注射 | リハビリ |
| 検査 | 特定の処置 |
| 画像診断 | |
| 入院基本料 |
DPCシステムの計算方法
計算式は以下の通りです:
「1日あたりの金額」×「入院日数」×「医療機関別係数」+「出来高計算分」
*医療機関別係数は各医療機関によって異なります。
例えば、患者が14日間入院した場合の計算は以下のようになります。
DPC名: 代謝障害(その他) 手術なし 手術処置等2なし
日数: 14
医療機関別係数: 0.0948 (例:神戸大学医学部附属病院)
入院費: ¥342,020 +出来高計算分
保険が適用されると、自己負担額は1割から3割になります。また、高額医療制度の対象となる場合、実際の自己負担額はさらに低くなります。
なお、上記の価格は2024年7月時点のものであり、最新の価格については随時ご確認ください。
年間治療費
外来通院を主とする場合、年間の治療費は約50万円から100万円程度になることがあります。入院を要する場合はさらに高額になります。
以上