感染症の一種であるアフリカトリパノソーマ症(アフリカ睡眠病)とは、蚊に似たツェツェバエという昆虫によって媒介される深刻な寄生虫感染症です。
この病気はトリパノソーマという原虫が引き起こし、主にアフリカ大陸の特定の地域で発生します。
初期症状は発熱や頭痛、関節痛などですが進行すると昼夜逆転や意識障害といった睡眠に関する症状が現れることから「睡眠病」とも呼ばれます。
早期発見と適切な対応が重要ですが診断が難しいこともあり注意が必要です。

病型 ガンビア型とローデシア型
アフリカトリパノソーマ症はその原因となる寄生虫の種類によって二つの病型に分類されます。
それぞれの病型は特徴的な地理的分布や進行速度を持ち、医療従事者にとって重要な識別ポイントとなっています。
病型の分類基準
アフリカトリパノソーマ症(アフリカ睡眠病)の病型は主に原因となる寄生虫の種類によって分類されます。
この分類は疫学的特徴や臨床経過の違いを反映しており、診断や管理方針の決定に大きな影響を与えます。
| 病型 | 原因寄生虫 |
| ガンビア型 | トリパノソーマ・ブルーセイ・ガンビエンセ |
| ローデシア型 | トリパノソーマ・ブルーセイ・ローデシエンセ |
地理的分布の特徴
二つの病型はアフリカ大陸内でも異なる地域で主に見られる傾向です。
この地理的な違いは媒介するツェツェバエの生息域や人々の生活様式などと密接に関連しています。
ガンビア型は西アフリカから中央アフリカにかけての地域で多く報告されており、主に熱帯雨林や湿地帯周辺で発生します。
一方ローデシア型は東アフリカおよび南部アフリカの一部の地域に限局して見られ、サバンナや乾燥地帯での発生が特徴的です。
感染源と伝播経路の違い
両病型は感染源となる宿主や伝播の仕方にも違いがあり、これは公衆衛生対策を立案する上で考慮すべき重要な要素となっています。
・ガンビア型
- 主に人間が感染源
- 人から人への感染が中心
・ローデシア型
- 野生動物や家畜が主な感染源
- 動物から人への感染が多い
臨床経過と進行速度
二つの病型は発症から重症化までの時間経過が異なることが知られています。
この進行速度の違いは患者さんの予後や必要とされる医療介入の緊急性に影響を与えます。
| 病型 | 進行速度 | 平均的な経過期間 |
| ガンビア型 | 緩徐 | 数ヶ月~数年 |
| ローデシア型 | 急速 | 数週間~数ヶ月 |
ガンビア型は比較的ゆっくりと進行し、感染から重症化までに長い時間がかかることが多いです。このため早期発見や適切な対応が可能となる場合が多く見られます。
対してローデシア型は急速に病状が悪化する傾向があり早期の診断と迅速な対応が不可欠です。

アフリカ睡眠病の主症状
アフリカトリパノソーマ症の主症状は多様で複雑であり、時に他の疾患と混同されることがあります。
しかし適切な知識と注意深い観察により早期発見の可能性は高まります。
感染初期から末期まで段階的に現れる症状を理解することで早期発見と適切な対応につながります。
本稿では病期ごとの特徴的な症状を詳しく解説します。
初期症状(血液リンパ系期)
感染後1〜3週間程度で現れる初期症状は非特異的なものが多く他の感染症との区別が難しいことがあります。
この時期の症状を見逃さないことが早期発見のカギとなるでしょう。
| 症状 | 特徴 |
| 発熱 | 間欠的で39℃以上に上昇することもある |
| 頭痛 | 持続的で鎮痛剤が効きにくい |
| 関節痛 | 全身の関節に現れることが多い |
| リンパ節腫脹 | 特にガンビア型で顕著 |
初期症状として注目すべきは「シャンカー」と呼ばれる特徴的な皮膚病変です。
これはツェツェバエに刺された部位に現れる赤い腫れで痛みを伴うことがあります。
シャンカーはローデシア型で顕著に見られますがガンビア型では出現しないこともあるため注意が必要です。
中期症状(髄膜脳炎期)
感染から数週間から数ヶ月経過すると次のような中枢神経系への影響が現れ始めます。
この時期の症状は患者さんの日常生活に大きな支障をきたし始める段階です。
- 睡眠障害(昼夜逆転など)
- 行動異常
- 集中力低下
- 協調運動障害
特に睡眠のリズムが乱れるためにこの疾患が「睡眠病」とも呼ばれている理由です。
昼間の眠気が強くなり夜間に不眠を訴えるなど生活リズムが大きく崩れることがあります。
晩期症状(脳症期)
病気が進行すると重度の神経症状が現れて患者さんの生命に関わる状態となります。
この段階では迅速かつ適切な医療介入が不可欠です。
| 症状 | 詳細 |
| 意識障害 | 昏睡状態に陥ることもある |
| 痙攣 | 全身性の発作が起こりうる |
| 不随意運動 | 手足の震えや異常な動きが見られる |
| 精神症状 | 幻覚や妄想などの症状が出現 |
晩期症状では自律神経系の障害も顕著となり体温調節異常や循環器系の問題が生じることがあります。
これらの症状は患者さんの全身状態を著しく悪化させる要因です。
病型による症状の違い
ガンビア型とローデシア型では症状の進行速度や一部の臨床像に違いが見られます。
この違いを理解することは診断や予後の予測において重要な意味を持ちます。
| 特徴 | ガンビア型 | ローデシア型 |
| 進行速度 | 緩徐(数ヶ月〜数年) | 急速(数週間〜数ヶ月) |
| 初期リンパ節腫脹 | 頸部後部に顕著 | 全身性に分布 |
| 心筋炎の頻度 | 比較的低い | 高い |
| 皮疹の特徴 | まれ | シャンカーが多い |
ガンビア型は比較的緩やかに進行するため早期発見の機会が多いのに対しローデシア型は急速に重症化するため迅速な対応が求められます。
2019年にJournal of Tropical Medicineに掲載された研究で中央アフリカのある地域でのガンビア型患者さん100例を追跡しました。
すると初期症状から中期症状への移行に平均6.8ヶ月かかったことが報告されています。
これはガンビア型の緩徐な進行を裏付ける重要な知見となりました。
非典型的な症状と注意点
アフリカトリパノソーマ症の症状は個人差が大きく非典型的な経過をたどることもあります。
次のような症状や状況では本疾患を疑う必要があります。
- 原因不明の長引く発熱
- アフリカ渡航歴後の慢性的な倦怠感
- 睡眠リズムの異常を伴う原因不明の体重減少
これらの症状がある場合、特にアフリカの流行地域への渡航歴がある際は専門医への相談を検討することが大切です。

アフリカトリパノソーマ症の原因と感染経路
アフリカトリパノソーマ症は複雑な感染経路と特殊な病原体によって引き起こされる深刻な疾患です。
原因を知り適切な対策を取ることで私たちはこの深刻な疾患のリスクを大幅に軽減することができるのです。
本稿では病原体の特性から感染のメカニズムまでを詳しく解説します。
病原体トリパノソーマ原虫の特徴
アフリカトリパノソーマ症の直接的な原因となるのはトリパノソーマ属に属する原虫です。
この微生物は単細胞生物でありながら複雑な生活環を持ち人間と動物の両方に感染する能力を有しています。
| 病型 | 原因となる原虫種 |
| ガンビア型 | トリパノソーマ・ブルーセイ・ガンビエンセ |
| ローデシア型 | トリパノソーマ・ブルーセイ・ローデシエンセ |
トリパノソーマ原虫は鞭毛を持つ運動性の高い生物で血液中を自由に泳ぎ回る能力があります。
この特性が全身への感染拡大を促進する要因となっているのです。
媒介昆虫ツェツェバエの役割
アフリカ睡眠病の感染には媒介昆虫であるツェツェバエが不可欠な役割を果たします。
ツェツェバエはアフリカ大陸の特定地域に生息する吸血性の昆虫で原虫を保有しています。
・ツェツェバエの生態的特徴
- 体長約1〜1.5cmの比較的大型の蠅
- 昼行性で活発に飛び回る
- 湿度の高い森林や河川沿いの茂みを好む
ツェツェバエは感染した動物や人間の血を吸うことで体内に原虫を取り込み次の獲物を刺すときにその原虫を伝播します。
この循環が地域における感染の連鎖を維持する主要因となっているのです。
感染経路と伝播サイクル
アフリカ睡眠病の感染経路は原虫を保有するツェツェバエに刺されることが主なものです。
しかし稀なケースとして他の経路での感染も報告されています。
| 感染経路 | 発生頻度 | 備考 |
| 虫刺し | 最多 | 主要な感染経路 |
| 母子感染 | 稀 | 胎盤を通じて胎児に感染の可能性 |
| 性行為感染 | 極稀 | 理論上可能だが報告例は少ない |
| 輸血感染 | 極稀 | 適切な血液スクリーニングで予防 |
ガンビア型とローデシア型では感染源となる宿主が異なることに注意が必要です。
ガンビア型は主に人間が感染源となるのに対しローデシア型は野生動物や家畜が主な感染源となります。
感染リスクを高める環境要因
アフリカトリパノソーマ症の感染リスクは地理的要因や生活環境に大きく影響されます。
特定の条件下では感染の機会が著しく増加することが知られています。
・高リスク環境
- ツェツェバエの生息地近くでの野外活動
- 感染地域での長期滞在や居住
- 家畜の飼育や野生動物との接触機会が多い職業
これらの環境に身を置く機会が多いほど感染のリスクは上昇します。
観光客や短期滞在者よりも現地で生活する人々や長期滞在者のほうが感染の機会に遭遇する可能性が高いといえるでしょう。
原虫の生存戦略と宿主内での挙動
トリパノソーマ原虫は宿主の免疫系から逃れるために巧妙な生存戦略を持っています。
この戦略が長期にわたる感染の持続を可能にし病気の進行を複雑にしています。
| 戦略 | 詳細 |
| 抗原変異 | 表面抗原を頻繁に変化させ免疫を回避 |
| 組織浸潤 | 血液から組織へ移動し免疫細胞から隠れる |
| 免疫抑制 | 宿主の免疫応答を直接的に抑制する物質を分泌 |
原虫は感染初期には血液やリンパ液中で増殖し後に中枢神経系へ侵入します。
この段階的な感染の進行が病気の特徴的な経過を生み出す要因となっているのです。

診察と診断プロセス
アフリカ睡眠病の診断は複雑で多段階のプロセスを要します。
初期症状が非特異的であることから正確な診断には専門的な知識と経験が求められ、複数の診断手法を組み合わせることで正確な診断に到達します。
本稿では診察から確定診断までの流れを詳細に解説します。
初診時の問診と身体診察
アフリカ睡眠病の診断において最初のステップは詳細な問診と綿密な身体診察です。
はじめに患者さんの渡航歴や滞在地域、特にツェツェバエの生息地への訪問歴を慎重に聴取します。
| 問診項目 | 着目点 |
| 渡航歴 | アフリカの該当地域への訪問有無 |
| 滞在期間 | 短期観光か長期滞在か |
| 虫刺され経験 | ツェツェバエに刺された記憶の有無 |
| 職業 | 野外活動や動物との接触機会の多寡 |
次の身体診察では特徴的な所見の有無を確認します。
ガンビア型とローデシア型では初期症状に違いがあるためそれぞれの特徴を念頭に置いた診察が必要です。
血液検査による原虫の検出
アフリカトリパノソーマ症の確定診断には血液中の原虫を直接観察することが不可欠です。
これには複数の手法が用いられ、それぞれに特徴があります。
・血液塗抹標本検査
- 薄層塗抹法と厚層塗抹法を併用
- ギムザ染色で原虫を可視化
・濃縮法
- 遠心分離やカラムクロマトグラフィーで原虫を濃縮
- 検出感度の向上が期待できる
これらの方法は熟練した技術者による顕微鏡観察が不可欠です。
原虫の数が少ない場合や間欠的に血中に出現する性質があるため複数回の検査が求められることがあります。
血清学的検査と分子生物学的手法
原虫の直接検出が困難な場合は補助的診断法として血清学的検査や分子生物学的手法が用いられます。
これらの方法は感度が高く、早期診断に役立つ可能性があります。
| 検査法 | 特徴 | 利点 |
| CATT | 凝集反応を利用した簡易検査 | フィールドでの使用に適する |
| ELISA | 抗体検出の高感度検査 | 定量的評価が可能 |
| PCR | 原虫DNAの増幅と検出 | 高感度・高特異度 |
| LAMP | 等温増幅法によるDNA検出 | 簡便で迅速 |
これらの検査は単独で確定診断とはならず他の所見と併せて総合的に判断されます。
偽陽性や偽陰性の可能性を考慮し結果の解釈には注意が必要です。
脳脊髄液検査による中枢神経系浸潤の評価
アフリカ睡眠病が進行すると原虫が中枢神経系に侵入しますが、この段階を評価するために脳脊髄液検査が実施されます。
・脳脊髄液検査の評価項目
- 原虫の存在
- 白血球数の増加
- タンパク質濃度の上昇
- IgM抗体の検出
これらの所見は病期の判定と治療方針の決定に重要な役割を果たします。
脳脊髄液検査は侵襲的な手技であるため実施にあたっては患者さんの状態や検査の必要性を慎重に検討することが大切です。

アフリカトリパノソーマ症の画像所見
アフリカ睡眠病の画像所見は非特異的であることが多いですが、他の神経疾患との鑑別や病変の広がりを評価する上で有用な情報を提供します。
しかし設備や専門技術を要するため流行地域のすべての医療機関で実施できるわけではありません。
本稿では主にMRIとCTで観察される特徴的な所見を詳しく解説してその解釈や臨床的意義について考察します。
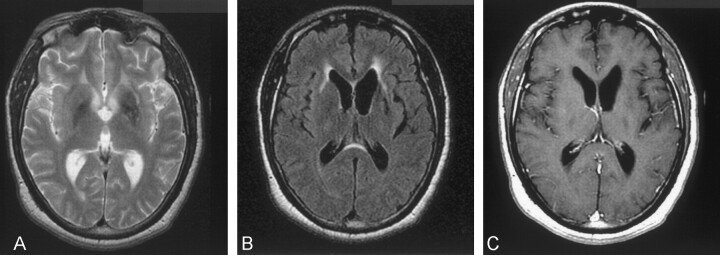
MRI所見の特徴と解釈
磁気共鳴画像法(MRI)はアフリカ睡眠病おける中枢神経系の変化を評価する上で非常に有用な画像診断法です。
特に髄膜脳炎期から脳症期にかけての病変を鮮明に描出することができます。
| MRI撮像法 | 主な所見 |
| T2強調画像 | 白質の高信号域・脳室周囲の浮腫 |
| FLAIR | 皮質下白質の高信号・脳溝の不明瞭化 |
| T1造影後画像 | 髄膜の造影効果・脳実質の斑状造影 |
| DWI | 急性期病変の高信号・細胞性浮腫の評価 |
T2強調画像やFLAIR画像では白質病変が高信号域として描出されることが多く、これは炎症や浮腫を反映していると考えられています。
一方 T1造影後画像では髄膜の造影効果が観察されることがあり血液脳関門の破綻を示唆する所見として解釈されます。
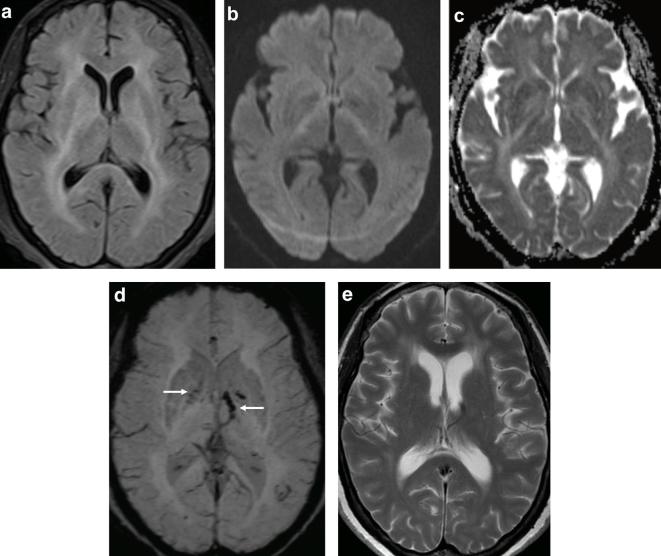
所見:「58歳女性、西アフリカトリパノソーマ症。(a)軸位T2W FLAIR画像では、深部白質、大脳基底核、内包および外包、脳梁の膨大部に両側性の高信号が確認される。(b)DWIでは、内包の後肢に微妙な高信号が認められ、ADCマップで対応する低信号が見られ、拡散制限と一致する。(c)SWIでは、両側の淡蒼球および左内包においてブルーミングアーチファクトが示され、微小出血が示唆される(矢印)。(d)4ヶ月後に実施された軸位T2画像では、間欠的な脳室拡大の発生と、残存する深部白質の信号異常が確認される。」
CT所見と臨床的意義
コンピュータ断層撮影(CT)は MRIほど詳細な軟部組織のコントラストは得られませんが広く普及しており緊急時の評価に役立ちます。
アフリカトリパノソーマ症のCT所見は非特異的なものが多いですが重要な情報を提供することがあります。
以下はCTで観察される主な所見です。
- 脳浮腫(低吸収域の拡大)
- 脳室の拡大
- 脳溝の狭小化
- 点状または斑状の石灰化病変
これらの所見は病期の進行や合併症の有無を評価する上で重要な手がかりとなるでしょう。
特に脳浮腫の程度や脳室の拡大は頭蓋内圧亢進の指標となり緊急治療の必要性を判断する際の参考になります。

画像所見の経時的変化
アフリカトリパノソーマ症の画像所見は病期の進行に伴い変化します。経時的な画像評価は病態の把握や治療効果の判定に役立つのです。
| 病期 | 主な画像所見 |
| 早期(血液リンパ系期) | 明らかな異常所見なし |
| 中期(髄膜脳炎期) | 散在性の白質病変・軽度の脳浮腫 |
| 後期(脳症期) | びまん性白質病変・脳萎縮・脳室拡大 |
早期では画像上の異常が検出されないことが多いため臨床症状と併せた総合的な評価が重要です。
中期から後期にかけては白質病変の範囲が拡大し最終的には脳萎縮や脳室拡大といった非可逆的な変化が観察されることがあります。
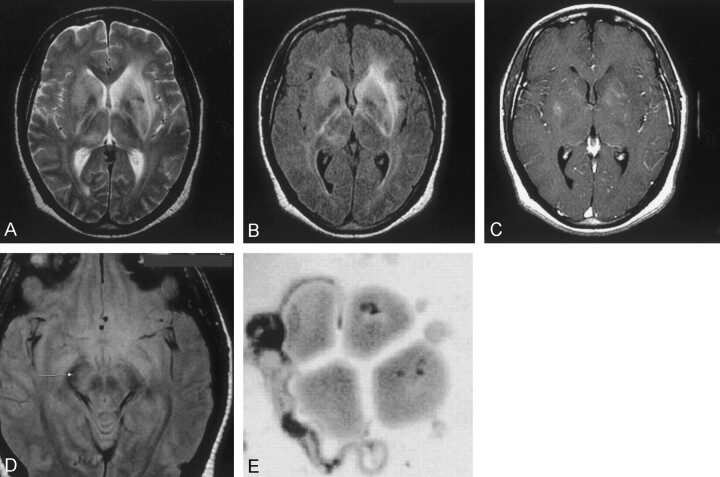
所見:「入院当日に脳のMRI検査が実施された(図1A-D)。T1強調画像、T2強調画像、および造影後の軸位および冠状断シーケンスを含む多断面液体抑制反転回復(FLAIR)MRIが行われた。MRI結果では、大脳基底核の信号強度の増加と、脳室周囲白質および中脳における高信号が確認された。患者は2週間の入院中、6時間ごとに100 mg/kgのエフロルニチンを投与されたが、この治療による臨床的な改善はわずかであった。1年後のフォローアップMRI検査では、初回画像と比較して、大脳基底核の白質の高信号領域が減少していることが示された。また、初回MRI検査以降、脳室の中程度の拡大が認められ、これは1年間で白質が減少したことを示唆している(図2A–C)。」
ガンビア型とローデシア型の画像所見の違い
ガンビア型とローデシア型では 病態の進行速度が異なるため画像所見にも若干の違いが見られることがあります。
しかし両者の画像所見を明確に区別することは困難であり臨床情報と併せた総合的な判断が必要です。
| 型 | 画像所見の特徴 |
| ガンビア型 | 緩徐な進行・白質病変が徐々に拡大 |
| ローデシア型 | 急速な進行・早期から広範な白質病変 |
ガンビア型では比較的長期間にわたり画像変化が緩やかに進行するのに対しローデシア型では短期間で顕著な変化が観察される傾向です。
このような違いは治療方針の決定や予後予測において参考になる可能性があります。
鑑別を要する疾患の画像所見
アフリカトリパノソーマ症の画像所見は他の中枢神経系感染症や炎症性疾患と類似することがあるため慎重な鑑別が必要です。
以下は鑑別を要する主な疾患です。
- 急性散在性脳脊髄炎(ADEM)
- 多発性硬化症
- 脳膿瘍
- 神経梅毒
これらの疾患との鑑別には画像所見だけでなく臨床経過や検査所見を総合的に評価することが不可欠です。
特に渡航歴や疫学的情報は アフリカトリパノソーマ症を疑う重要な手がかりとなります。

アフリカ睡眠病の治療戦略と経過
アフリカトリパノソーマ症の治療は複雑で長期にわたることがあります。
病期や病型によって使用する薬剤が異なり治癒までの期間も様々です。
本稿では治療法の選択基準から使用薬剤、そして治療期間について詳しく解説します。
病期に応じた治療法の選択
アフリカトリパノソーマ症の治療は病期によって大きく異なります。
早期の血液リンパ系期と後期の中枢神経系期で使用する薬剤が異なるため正確な病期診断が治療成功の鍵です。
| 病期 | 主な治療薬 | 投与経路 |
| 血液リンパ系期 | ペンタミジン、スラミン | 筋肉内・静脈内 |
| 中枢神経系期 | メラルソプロール、エフロルニチン | 静脈内 |
血液リンパ系期の治療は比較的安全で効果的ですが、中枢神経系期の治療はより複雑で副作用のリスクが高くなります。
そのため早期発見・早期治療が患者さんの予後を大きく左右する要因なのです。
ガンビア型とローデシア型の治療の違い
ガンビア型とローデシア型では使用する薬剤や治療アプローチに違いがあります。
これは原因となる寄生虫の種類や病態の進行速度の違いによるものです。
ガンビア型の治療特徴は次の通りです。
- エフロルニチンが第一選択薬として使用される
- 比較的緩やかな経過のため治療の余裕がある
一方ローデシア型の治療特徴は下記の通りです。
- メラルソプロールが主に使用される
- 急速に進行するため迅速な治療開始が求められる
ガンビア型ではエフロルニチンとニフルチモックスの併用療法が近年注目されており、治療期間の短縮や副作用の軽減が期待されています。
ローデシア型ではメラルソプロールの単剤療法が依然として主流ですが、新しい治療法の研究も進められています。
主要な治療薬の特徴
アフリカトリパノソーマ症の治療に用いられる薬剤にはそれぞれ特徴的な作用機序があります。これらを理解することは治療経過の管理において重要です。
| 薬剤名 | 主な作用機序 |
| ペンタミジン | DNA合成阻害 |
| スラミン | 解糖系酵素阻害 |
| メラルソプロール | タンパク質合成阻害 |
| エフロルニチン | ポリアミン合成阻害 |
治療期間と経過観察
アフリカトリパノソーマ症の治療期間は使用する薬剤や患者さんの状態によって異なりますが、一般的に数週間から数ヶ月に及ぶことがあります。
さらに治療後も長期的な経過観察が必要です。
| 治療段階 | 期間 | 主な評価項目 |
| 初期治療 | 1〜4週間 | 臨床症状の改善・血中寄生虫の消失 |
| 経過観察 | 2年間 | 再発の有無・髄液検査の正常化 |
治療効果の判定には臨床症状の改善と共に血液および髄液中の寄生虫の消失が確認されることが重要です。
2018年にLancet Infectious Diseasesに掲載された研究ではガンビア型トリパノソーマ症患者さん264名を対象にエフロルニチンとニフルチモックスの併用療法の有効性が検討されました。
その結果18ヶ月後の治癒率が91.2%に達し、従来の単剤療法と比べて治療期間の大幅な短縮と副作用の軽減が確認されました。
この研究は新しい治療アプローチの有効性を示す重要な証拠となりました。

治療の副作用とリスク管理
アフリカトリパノソーマ症の治療には様々な副作用やリスクが伴います。
使用される薬剤の強力な作用によっては患者さんの身体に大きな負担がかかることがあります。
治療に伴うリスクと利益のバランスを慎重に評価して個々の患者さんに最適な治療アプローチを選択することがアフリカトリパノソーマ症管理の鍵となるでしょう。
本稿では主な治療薬の副作用とそのリスク管理について詳しく解説します。
ペンタミジンによる副作用
ペンタミジンは血液リンパ系期のガンビア型トリパノソーマ症に対して使用される薬剤ですが、いくつかの重要な副作用に注意が必要です。
この薬剤は腎臓や膵臓に影響を与える可能性があるため投与中は慎重なモニタリングが求められます。
| 主な副作用 | 発生頻度 | 対処法 |
| 低血糖 | 高頻度 | 血糖値モニタリング・糖分補給 |
| 腎機能障害 | 中頻度 | 腎機能検査・水分摂取管理 |
| 膵炎 | 低頻度 | 腹痛の観察・血中酵素モニター |
| 注射部位反応 | 高頻度 | 局所冷却・投与部位の変更 |
低血糖は特に注意が必要な副作用であり突然の意識消失などを引き起こす可能性があります。
患者さんや介護者に対して低血糖の症状と対処法について十分な説明を行うことが重要です。
スラミンに関連する有害事象
スラミンはローデシア型アフリカ睡眠病の初期治療に用いられますが、アレルギー反応や腎障害などの副作用が知られています。
この薬剤の使用には細心の注意が必要で投与前後の患者さんの状態観察が欠かせません。
スラミン投与時の注意点は以下の通りです。
- アレルギー反応の早期発見と対応
- 腎機能の定期的なチェック
- 皮膚反応の観察と局所ケア
- 神経毒性の兆候モニタリング
特にアレルギー反応は重篤化する可能性があるため投与開始時は医療機関での厳重な管理下で行われることが多いです。
また、腎機能障害のリスクを考慮して十分な水分摂取と尿量のモニタリングが推奨されます。
メラルソプロールの深刻な副作用
メラルソプロールは中枢神経系期の治療に用いられる重要な薬剤ですが、その使用には重大なリスクが伴います。
特に治療関連脳症は生命を脅かす可能性のある深刻な副作用として知られています。
| 副作用 | 発生率 | 臨床的特徴 |
| 治療関連脳症 | 5-10% | 意識障害・痙攣・昏睡 |
| 肝機能障害 | 中等度 | 黄疸・肝酵素上昇 |
| 心臓毒性 | 低頻度 | 不整脈・心不全 |
| 末梢神経障害 | 高頻度 | しびれ・感覚異常 |
治療関連脳症は投与開始後数日以内に発症することが多く、迅速な対応が求められます。
発症リスクを最小限に抑えるためには投与量や投与間隔の調整、副腎皮質ステロイドの併用などが検討されることがあります。
エフロルニチンの長期使用に伴うリスク
エフロルニチンはガンビア型アフリカ睡眠病の中枢神経系期に有効な薬剤ですが、長期投与に伴う副作用にも注意が必要です。
具体的には骨髄抑制や脱毛などが主な副作用として報告されています。
以下はエフロルニチン長期使用のリスクです。
- 貧血や白血球減少などの血液学的異常
- 可逆性の脱毛
- 聴力低下
- 消化器症状(悪心・嘔吐・下痢)
これらの副作用の多くは可逆的であり投与終了後に改善することが多いとされています。
しかし長期にわたる入院治療や頻回の点滴投与が必要となるため患者さんのQOLに大きな影響を与える可能性があります。
薬剤耐性の問題とその対策
アフリカトリパノソーマ症の治療において薬剤耐性の出現は深刻な問題となっています。
特定の薬剤に対する耐性獲得により治療の選択肢が制限されるリスクがあります。
| 薬剤 | 耐性獲得報告 | 対策 |
| メラルソプロール | 散発的 | 投与量・期間の最適化 |
| ペンタミジン | 稀 | 他剤との併用療法の検討 |
| エフロルニチン | 報告なし | モニタリングの継続 |
薬剤耐性の問題に対処するため新規薬剤の開発や既存薬の組み合わせによる治療法の最適化が進められています。

治療費
アフリカトリパノソーマ症の治療費は使用する薬剤や入院期間によって大きく変動します。
本稿では一般的な治療費の目安を解説して経済的負担の実態に迫ります。
処方薬の薬価
アフリカ睡眠病の治療に用いられる薬剤はその希少性から高価格となります。
ペンタミジンやメラルソプロールなどの主要薬剤は1回の投与あたり数万円から十数万円の範囲に及びます。
| 薬剤名 | 1回投与あたりの薬価 |
| ペンタミジン | 6510円 |
| メラルソプロール | 本邦では保険収載なし |
1週間の治療費
初期治療では連日の薬剤投与と入院管理が必要となり、1週間の治療費は高額です。
薬剤費に加えて入院費や検査費用を含めるとおよそ100万円から150万円程度の費用が発生する可能性があります。
1か月の治療費
長期的な治療が必要な場合、1か月の治療費は更に膨らみます。
- 薬剤費
- 入院費
- 検査費用
- リハビリテーション費用
これらを合わせると300万円から500万円程度の費用がかかる場合もあるかもしれません。
ただし、公的医療保険、高額療養制度などの医療費削減を行う事が出来るため、かなり安くなると思われます。
なお、上記の価格は2024年10月時点のものであり、最新の価格については随時ご確認ください。
以上

- 参考にした論文