感染症の一種であるリーシュマニア症とはサシチョウバエという小さな虫によって媒介される寄生虫感染症です。
この病気は熱帯や亜熱帯地域を中心に世界中で見られ、皮膚や内臓に影響を及ぼす可能性があります。
症状は感染部位によって異なりますが皮膚病変・発熱・体重減少などが一般的です。
リーシュマニア症は適切な診断と治療が重要な疾患で公衆衛生上の課題となっています。

病型:皮膚・内臓・粘膜皮膚型の特徴
リーシュマニア症は感染部位によって異なる病型を示します。
そのため各病型の正確な診断と適切な対応が患者さんの予後を左右する重要な要素となります。
本項では主要な3つの病型について詳しく解説します。
皮膚リーシュマニア症
皮膚リーシュマニア症は最も一般的な病型であり主に皮膚組織に影響を及ぼします。
この病型は世界中の熱帯および亜熱帯地域で広く見られ、地域によって臨床像が異なることがあります。
以下は皮膚リーシュマニア症の特徴です。
- 感染部位に限局した皮膚病変
- 自然治癒する可能性がある
- 複数の病変が同時に現れることがある
皮膚リーシュマニア症の病変の形態や進行速度は原因となる寄生虫の種類や宿主の免疫状態によって大きく異なります。
内臓リーシュマニア症
内臓リーシュマニア症は最も深刻な病型であり内臓器官特に肝臓脾臓および骨髄に影響を与えます。
この病型は特定の地域で流行し公衆衛生上重要な課題となっています。
以下は内臓リーシュマニア症の特徴です。
- 全身性の感染症状
- 慢性的な経過をたどることが多い
- 適切な対応がなされない場合致命的になる可能性がある
内臓リーシュマニア症の影響を受ける主な臓器と症状は以下の通りです。
| 臓器 | 主な影響 |
| 肝臓 | 肝腫大・肝機能障害 |
| 脾臓 | 脾腫・貧血 |
| 骨髄 | 造血機能障害・免疫機能低下 |
粘膜皮膚リーシュマニア症
粘膜皮膚リーシュマニア症は皮膚と粘膜の両方に病変を引き起こす複雑な病型です。
この病型は主に中南米地域で見られ長期にわたって進行することがあります。
以下は粘膜皮膚リーシュマニア症の特徴です。
- 初期は皮膚病変として始まる
- 後に粘膜にも病変が及ぶ
- 顔面の変形を引き起こす場合がある
粘膜皮膚リーシュマニア症の進行段階と主な影響部位は次の通りです。
| 進行段階 | 主な影響部位 |
| 初期 | 皮膚・特に露出部位 |
| 中期 | 鼻腔・口腔粘膜 |
| 後期 | 咽頭・喉頭・気管支 |
病型の相互関係
リーシュマニア症の各病型は独立して発症することもありますが時に相互に関連することもあります。
例えば皮膚リーシュマニア症から粘膜皮膚リーシュマニア症へと進行するケースや内臓リーシュマニア症に皮膚症状を伴うケースなどが報告されています。
これらの病型間の関係を理解することは診断および経過観察において不可欠です。
| 関連パターン | 発生頻度 |
| 皮膚→粘膜皮膚 | 比較的稀 |
| 内臓+皮膚 | 地域により異なる |
| 3病型の複合 | 非常に稀 |
医療従事者は患者さんの渡航歴や曝露リスクなどを考慮しつつ総合的な評価を行うことが求められます。
また患者さん自身も自覚症状や生活環境の変化に注意を払い早期発見早期対応に努めることが大切です。

リーシュマニア症の主症状
リーシュマニア症の症状は感染部位や病型によって大きく異なります。
リーシュマニア症の症状を正確に把握することは 早期診断と適切な対応を行う上で不可欠です。
多様な症状の組み合わせや経時的変化を注意深く観察すること 診断の精度を高めるために重要です。
本稿では皮膚・内臓・粘膜皮膚の各病型における主要な症状について詳しく解説します。
皮膚リーシュマニア症の症状
皮膚リーシュマニア症は最も一般的な病型であり主に皮膚に症状が現れます。
初期症状として感染部位に小さな赤い丘疹が形成されることが多いです。
この丘疹は時間とともに大きくなり、やがて潰瘍化することがあります。
皮膚リーシュマニア症の主な症状は次のようなものです。
- 紅斑や丘疹の形成
- 皮膚潰瘍の発生
- 痂皮(かひ)の形成
- 色素沈着や瘢痕化
| 症状 | 特徴 |
| 紅斑・丘疹 | 直径1〜10mm程度・無痛性 |
| 潰瘍 | 辺縁が隆起・中心部が陥凹 |
| 瘢痕 | 治癒後も残存・色素沈着を伴う |
皮膚病変の数は単発のこともあれば多発することもあります。
内臓リーシュマニア症の症状
内臓リーシュマニア症は 最も重篤な病型であり全身性の症状を呈します。
主に肝臓・脾臓・骨髄が侵されるため、これらの臓器に関連した症状が現れます。
内臓リーシュマニア症の主要な症状は以下の通りです。
- 断続的または持続性発熱
- 肝脾腫 肝臓と脾臓の腫大
- 体重減少
- 貧血
- 全身倦怠感
| 症状 | 発現頻度 |
| 発熱 | 95%以上 |
| 肝脾腫 | 90%以上 |
| 貧血 | 80%以上 |
| 体重減少 | 70%以上 |
これらの症状は徐々に進行して数週間から数か月にわたって悪化することがあります。
2010年にインドで行われた研究では内臓リーシュマニア症患者さんの約85%が6か月以上の慢性的な経過を辿ったことが報告されています。
粘膜皮膚リーシュマニア症の症状
粘膜皮膚リーシュマニア症は皮膚と粘膜の両方に症状が現れる複雑な病型です。
初期は皮膚病変として始まりその後粘膜にも症状が波及します。
粘膜皮膚リーシュマニア症の特徴的な症状は次のようなものです。
- 鼻粘膜の潰瘍形成
- 鼻中隔の穿孔
- 口腔内病変
- 咽頭や喉頭の病変
| 病変部位 | 主な症状 |
| 鼻 | 鼻閉・鼻出血・鼻変形 |
| 口腔 | 口内炎・歯肉炎・舌炎 |
| 咽喉頭 | 嚥下困難・嗄声 |
粘膜病変は進行性で放置すると顔面の著しい変形を引き起こす可能性があります。
非特異的症状と全身症状
リーシュマニア症では病型に関わらず非特異的な全身症状が現れることがあります。
これらの症状は他の多くの疾患でも見られるため診断を困難にする要因となります。
主な非特異的症状と全身症状は以下の通りです。
- 倦怠感
- 食欲不振
- 微熱
- リンパ節腫脹
- 筋肉痛や関節痛
| 症状 | 特徴 |
| 倦怠感 | 持続的 日常生活に支障 |
| 食欲不振 | 体重減少を伴う |
| 微熱 | 37〜38度程度 長期間持続 |
これらの症状は 感染初期から現れることがあり 診断の重要な手がかりとなります。
症状の経時的変化
リーシュマニア症の症状は時間とともに変化して複雑な経過を辿ることがあります。
初期症状が軽微であるため見逃されやすい点が特徴です。
以下のような症状の進行パターンをたどるのが一般的です。
| 病期 | 主な特徴 |
| 潜伏期 | 無症状・数週間〜数か月 |
| 初期 | 軽度の全身症状 |
| 進行期 | 典型的な症状の出現 |
| 慢性期 | 症状の長期化・合併症 |
症状の進行速度や重症度は個人の免疫状態や感染した原虫の種類によって大きく異なります。

リーシュマニア症の原因とメカニズム解明
リーシュマニア症は複雑な感染経路を持つ寄生虫疾患です。
リーシュマニア症の原因やきっかけを理解することは予防や制御において重要な役割を果たします。
複雑な感染サイクルや環境要因 宿主因子などを総合的に考慮することでより効果的な対策が可能となるのです。
本項ではその原因となる病原体や感染メカニズムについて詳しく解説します。
病原体リーシュマニア原虫
リーシュマニア症の直接的な原因はリーシュマニア属に分類される単細胞の寄生虫です。
この原虫は非常に小さく顕微鏡でしか観察できないほどのサイズです。
リーシュマニア属には20種以上の異なる種が存在しそれぞれが特定の地域や宿主に適応しています。
主要なリーシュマニア種とその特徴は以下の通りです。
| 種名 | 主な分布地域 | 引き起こす主な病型 |
| L. donovani | インド亜大陸・東アフリカ | 内臓リーシュマニア症 |
| L. infantum | 地中海沿岸・中東 | 内臓リーシュマニア症 |
| L. major | 北アフリカ・中東・中央アジア | 皮膚リーシュマニア症 |
| L. tropica | 都市部の中東・インド | 皮膚リーシュマニア症 |
| L. braziliensis | 中南米 | 粘膜皮膚リーシュマニア症 |
これらの原虫は宿主の体内で二つの主要な形態をとります。
- アマスティゴート形態 哺乳類の細胞内で増殖
- プロマスティゴート形態 サシチョウバエの消化管内で生存・増殖
媒介者サシチョウバエ
リーシュマニア原虫を人間や他の哺乳類に伝播する役割を果たすのがサシチョウバエです。
このハエは非常に小さくて体長は2〜3mm程度しかありません。
サシチョウバエの生態学的特徴は次の通りです。
| 特徴 | 詳細 |
| 活動時間 | 主に夕暮れから夜間 |
| 生息環境 | 湿った有機物の多い場所 |
| 飛行能力 | 弱く 数百メートル程度 |
| 寿命 | 約1か月 |
サシチョウバエは吸血の際にリーシュマニア原虫を体内に取り込み、次の吸血時に新たな宿主に感染させます。
感染サイクル
リーシュマニア症の感染サイクルは非常に複雑で原虫とサシチョウバエ そして哺乳類宿主の間で成立します。
このサイクルは以下のような段階を経て進行します。
- 感染したサシチョウバエが哺乳類に吸血する
- 原虫が宿主の体内に侵入しマクロファージなどの細胞に寄生
- 細胞内でアマスティゴート形態に変化し増殖
- 感染細胞が破壊され新たな細胞に感染を広げる
- 未感染のサシチョウバエが感染宿主から吸血
- 原虫がハエの体内でプロマスティゴート形態に変化
- ハエの唾液腺に移動し次の吸血の機会を待つ
このサイクルが継続することで感染が維持・拡大していきます。
環境要因と宿主因子
リーシュマニア症の発生には様々な環境要因と宿主因子が関与しています。
これらの要因が複合的に作用することで 感染リスクが高まるのです。
主な環境要因には以下のようなものがあります。
- 気候条件 高温多湿な環境がサシチョウバエの繁殖に好適
- 都市化 不衛生な環境がサシチョウバエの生息地となる
- 森林伐採 野生動物の生息地破壊により人間との接触機会が増加
| 環境要因 | リスク増加のメカニズム |
| 気候変動 | サシチョウバエの生息域拡大 |
| 貧困 | 不十分な衛生環境や栄養状態 |
| 人口移動 | 非感染地域への病原体の持ち込み |
宿主因子としては免疫状態が重要です。
HIV感染者や栄養不良の人々はリーシュマニア症に対してより脆弱であることが知られています。
遺伝的要因と進化
リーシュマニア原虫の遺伝的多様性も感染症の複雑さに寄与しています。
原虫は長い進化の過程で様々な環境に適応してきました。
この適応過程で獲得された遺伝的特徴が 以下のような影響を及ぼしています。
- 薬剤耐性の獲得
- 宿主免疫系からの回避能力の向上
- 異なる宿主や媒介者への適応
| 遺伝的特徴 | 感染症への影響 |
| 表面抗原の多様性 | 免疫回避 |
| 代謝経路の変化 | 異なる環境への適応 |
| 遺伝子コピー数の変異 | 薬剤感受性の変化 |
これらの遺伝的要因を理解することは効果的な対策を講じる上で不可欠です。

診察と診断
リーシュマニア症の診断は臨床症状の評価・疫学的情報の収集・様々な検査法を組み合わせて行われます。
また 診断の過程では他の感染症や腫瘍性疾患との鑑別も同時に行われます。
本項では診察から確定診断に至るまでのプロセスを詳しく解説します。
臨床症状の評価
診察の第一歩は患者さんの臨床症状を丁寧に評価することから始まります。
医師は患者さんの全身状態を観察して特徴的な所見がないか注意深く確認します。
皮膚病変の有無や性状、内臓の腫大、全身状態の変化などが主な観察ポイントです。
リーシュマニア症の各病型に応じた主な診察項目は次の通りです。
- 皮膚リーシュマニア症 皮膚病変の詳細な観察と記録
- 内臓リーシュマニア症 肝臓や脾臓の触診 全身状態の評価
- 粘膜皮膚リーシュマニア症 口腔内や鼻腔の粘膜病変の観察
| 病型 | 主な診察項目 |
| 皮膚型 | 潰瘍の大きさ・数・分布 |
| 内臓型 | 肝脾腫の程度・リンパ節腫脹 |
| 粘膜皮膚型 | 鼻中隔穿孔・口腔内病変 |
これらの臨床所見は診断の方向性を決定する上で重要な役割を果たします。
疫学的情報の収集
リーシュマニア症の診断において患者さんの渡航歴や居住歴などの疫学的情報を収集することが不可欠です。
医師は問診を通じて 以下のような情報を詳しく聴取します。
- 流行地域への渡航歴
- 動物との接触歴
- 職業や生活環境
- 家族や周囲の人の健康状態
| 聴取項目 | 具体例 |
| 渡航歴 | 中東、南アジア、南米への旅行 |
| 動物接触 | イヌやげっ歯類との接触機会 |
| 生活環境 | 森林近くでの居住・都市のスラム |
これらの情報は 感染の機会やリスク因子を特定する上で重要な手がかりとなります。
価する上で大切な手段となります。
血液検査と生化学検査
リーシュマニア症の診断過程で 様々な血液検査や生化学検査が実施されます。
これらの検査は患者さんの全身状態を評価し他の疾患との鑑別を行う上で重要です。
主な検査項目とその意義は次の通りです。
| 検査項目 | 主な異常所見 |
| 血球計算(貧血や血小板減少の評価) | 汎血球減少 |
| 肝機能 | トランスアミナーゼ上昇 |
| 腎機能 | クレアチニン上昇 |
| 炎症マーカー(全身の炎症状態を評価) | CRP ESR上昇 |
これらの検査結果は診断の補助となるだけでなく患者さんの全身状態を把握する上でも重要な情報源となります。
特異的診断法
リーシュマニア症の確定診断には病原体を直接検出する方法や免疫学的検査が用いられます。
これらの特異的診断法は高い精度で感染の有無を判定することが可能です。
主な特異的診断法には以下のようなものがあります。
- 顕微鏡検査 病変部位の組織や血液中の原虫を直接観察
- PCR法 原虫のDNAを増幅して検出
- 血清学的検査 原虫に対する抗体を検出
| 診断法 | 特徴 |
| 顕微鏡検査 | 迅速だが感度が低い |
| PCR法 | 高感度かつ特異的 |
| 血清学的検査 | スクリーニングに適する |
これらの検査を組み合わせることで断の精度を高めることが可能となります。

リーシュマニア症の画像所見 多様な病型に応じた特徴的な画像診断
リーシュマニア症の画像診断は病型や感染部位によって異なる特徴的な所見を示します。
病型や病期によって多様な所見を呈するため総合的な判断が求められます。
本稿では各病型における画像所見の特徴と診断における画像検査の役割について詳しく解説します。
皮膚リーシュマニア症の画像所見
皮膚リーシュマニア症では主に皮膚の病変を評価するための画像検査が行われます。
超音波検査やMRIが用いられることがありこれらの検査では皮膚病変の深さや範囲を詳細に評価することができます。
以下は皮膚リーシュマニア症の主な画像所見です。
- 皮膚の肥厚
- 皮下組織の浮腫
- 潰瘍形成部位の組織欠損
| 画像検査 | 主な所見 |
| 超音波 | 皮膚肥厚・低エコー領域 |
| MRI | T2強調像での高信号・造影効果 |
これらの画像所見は病変の進行度や治療効果の評価に役立ちます。
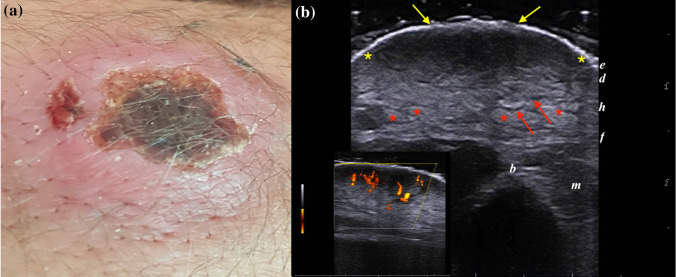
所見:「(a) 18歳男性の臨床および超音波所見。右肘にかさぶたを伴う中心部と隆起した辺縁を持つLCL(皮膚型リーシュマニア症)プラークが認められる。(b) 18 MHzのグレースケール超音波検査では、混合エコー性を示す不明瞭な皮膚・皮下構造が筋膜平面まで広がっていることが確認される(黄色マーカー間)。表皮層の消失(黄色矢印)、脂肪小葉のエコー増加(赤マーカー)、および小葉間スペースの拡張(赤矢印)が確認される。左下のPDUSドプラーでは、病変中心部に著しい血管信号が認められ、炎症パターンと一致している。」
内臓リーシュマニア症の画像所見
内臓リーシュマニア症では主に肝臓・脾臓・リンパ節などの内臓器官の変化を評価するための画像検査が重要です。
超音波検査・CT・MRIなどが用いられそれぞれの検査法で特徴的な所見が観察されます。
内臓リーシュマニア症の主な画像所見は次の通りです。
- 肝脾腫 肝臓と脾臓の著明な腫大
- リンパ節腫大
- 骨髄の信号変化
| 臓器 | 画像所見 |
| 肝臓 | 腫大・不均一な実質 |
| 脾臓 | 著明な腫大・多発性低吸収域 |
| リンパ節 | 全身性腫大・造影効果 |
これらの所見は内臓リーシュマニア症の診断や経過観察において不可欠な情報を提供します。
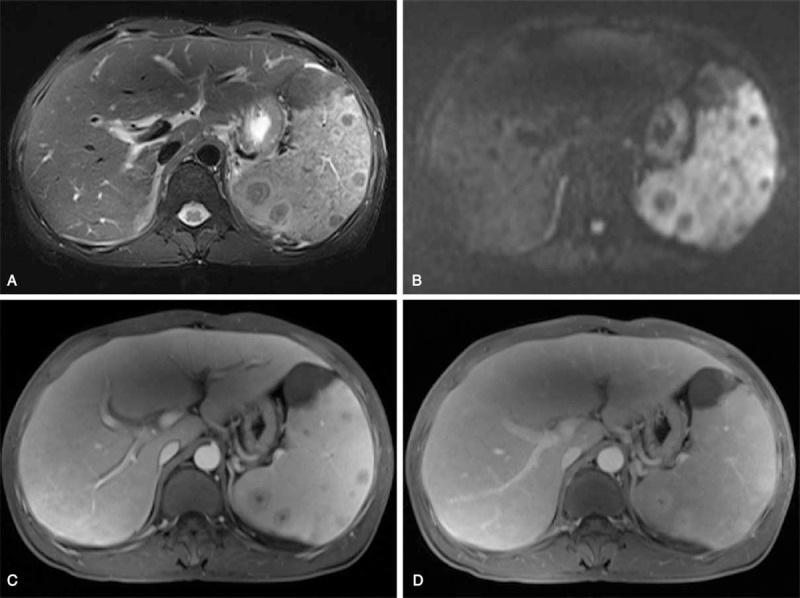
所見:「MRIでは、脾臓が軽度に腫大しており、脾実質内に複数の結節が認められ、脾臓の前面に梗塞が見られた。病変は同心円状に表示され、中央部に点状の高信号、外側のリングは低信号、その内側にやや高信号のリングが一部の結節に認められ、最も外側のリングは結節を囲む高信号でT2WI(A)で確認された。DWI(B)では、やや低信号で、時には中央に低信号の点が見られた。造影後、門脈相(C)ではリング状の形で軽度の造影効果が見られ、遅延相(D)では周囲の正常な脾実質よりも相対的に高信号となった。T2WIで高信号を示した中央部と最も外側の領域には造影効果が認められなかった。」
粘膜皮膚リーシュマニア症の画像所見
粘膜皮膚リーシュマニア症では主に顔面や口腔、鼻腔の病変を評価するための画像検査が行われます。
CT・MRI・内視鏡検査などが用いられ、軟部組織の変化や骨破壊の有無が評価されます。
粘膜皮膚リーシュマニア症の特徴的な画像所見は次のようなものです。
- 鼻中隔穿孔
- 口腔粘膜の肥厚
- 顔面骨の破壊性変化
| 部位 | 主な画像所見 |
| 鼻腔 | 鼻中隔欠損・粘膜肥厚 |
| 口腔 | 軟口蓋の肥厚・潰瘍形成 |
| 顔面骨 | 骨破壊・骨膜反応 |
これらの所見は病変の範囲や重症度を評価する上で重要な情報となります。

所見:「粘膜型リーシュマニア症。CTスキャンでは、左上顎洞炎および鼻中隔軟骨に1センチメートルの穿孔が確認されている。」
画像検査の選択と解釈
リーシュマニア症の画像診断では病型や臨床症状に応じて適切な検査法を選択することが大切です。
各画像検査法にはそれぞれ特徴や長所があり、それらを組み合わせることで より詳細な情報が得られます。
主な画像検査法の特徴と利点は以下の通りです。
- 超音波検査 非侵襲的でリアルタイムの観察が可能
- CT 広範囲の評価に適し 骨病変の検出に優れる
- MRI 軟部組織のコントラスト分解能が高い
| 検査法 | 主な利点 | 制限 |
| 超音波 | 簡便・低コスト | 深部評価が困難 |
| CT | 広範囲評価・骨評価 | 放射線被ばく |
| MRI | 軟部組織評価 | 長時間・高コスト |
これらの検査法を適切に選択して組み合わせることで診断精度の向上が期待できます。
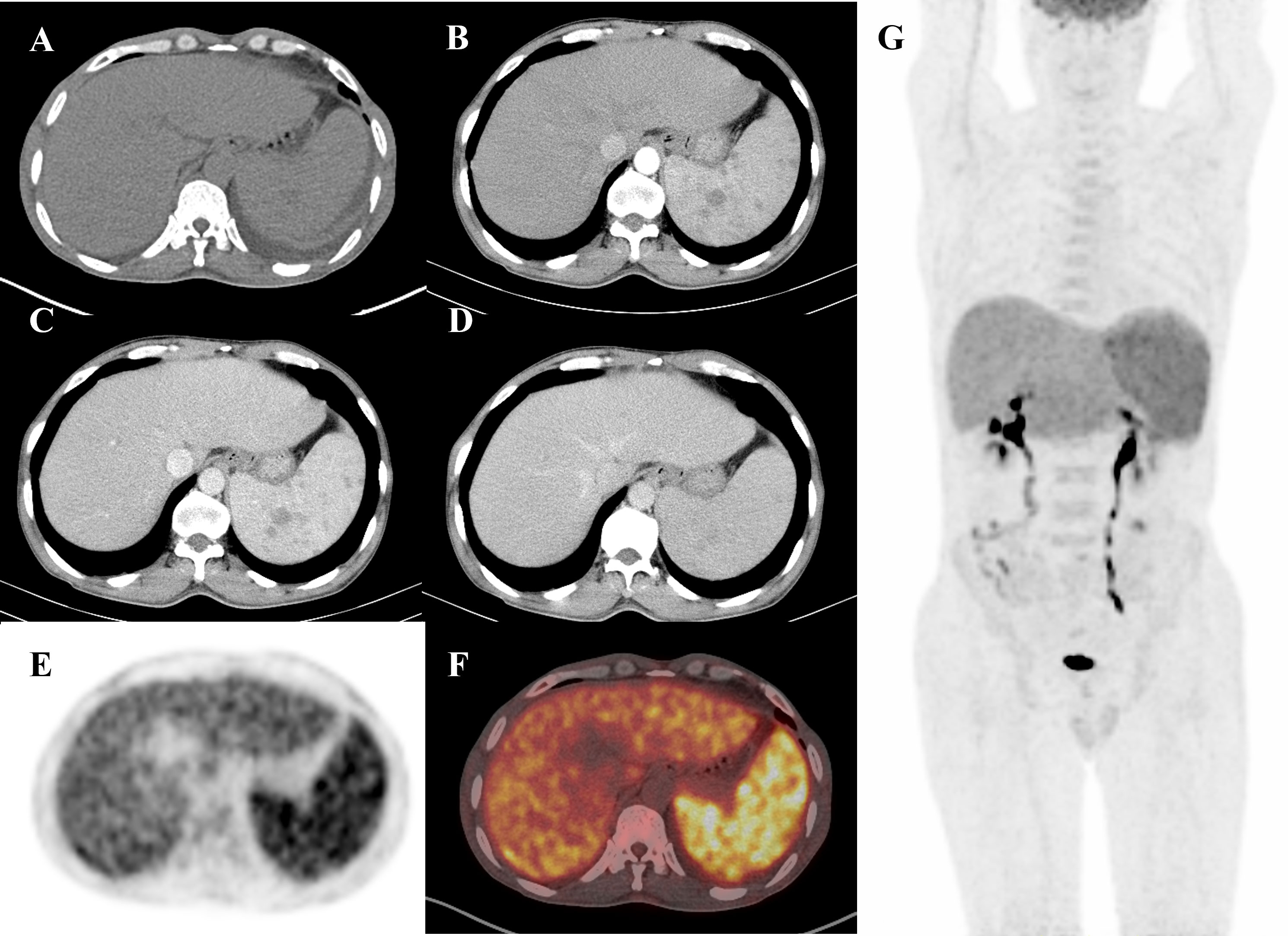
所見:「55歳男性、1ヶ月間の発熱を訴え来院。発熱の原因不明(FUO)に対する通常の診断検査では、原因が特定されなかったため、核医学科に紹介され、18F-FDG PET/CTスキャンを実施(軸位CT、造影CT、PET、融合、および最大強度投影(MIP))。非造影軸位CT(A)では脾腫のみが確認されたが、PET(E)および融合画像(F)では、脾腫にFDGのびまん性取り込みが認められ、最大標準化取り込み値(SUV max)は6.6であった。MIP画像(G)では、拡大した脾臓におけるFDG取り込みの増加が示され、腹部造影CT(B–D)で遅延造影を伴う多発性低密度結節が見られ、リンパ腫に類似していた。病理学的検査の結果、脾摘後に内臓リーシュマニア症(VL)と診断された。患者はアンホテリシンBによる治療を受け、発熱もなく退院した。」
経時的画像評価の意義
リーシュマニア症の経過観察において経時的な画像評価は重要な役割を果たします。
定期的に画像検査を行うことで病変の進行や治療効果を客観的に評価することができます。
経時的画像評価の主な意義は次の通りです。
- 治療効果の判定
- 再発の早期発見
- 合併症の検出
| 評価項目 | 画像所見の変化 |
| 治療効果 | 病変サイズの縮小・浮腫の改善 |
| 再発 | 新規病変の出現・既存病変の増大 |
| 合併症 | 二次感染や瘢痕形成の評価 |
これらの経時的変化を注意深く観察することでより適切な管理が可能となります。

リーシュマニア症の治療法と回復期間
リーシュマニア症の治療は病型や重症度に応じて異なるアプローチが取られますが個々の患者さんの状態に応じて慎重に選択される必要があります。
合併症の有無や地域の薬剤耐性パターンなども考慮に入れつつ最適な治療法が選択されます。
本記事では各病型における主要な治療法・使用される薬剤・治癒までの期間について詳しく解説します。
全身療法の基本
リーシュマニア症の治療では全身に作用する薬剤を用いた全身療法が基本となります。
これは特に内臓リーシュマニア症や重症の皮膚リーシュマニア症において重要です。
全身療法に用いられる主な薬剤には以下のようなものがあります。
| 薬剤名 | 投与経路 | 主な適応 |
| 五価アンチモン製剤 | 静脈内/筋肉内 | 全病型 |
| リポソーマルアムホテリシンB | 静脈内 | 内臓型・重症皮膚型 |
| ミルテホシン | 経口 | 内臓型・皮膚型 |
| パロモマイシン | 筋肉内 | 皮膚型・内臓型 |
これらの薬剤は単独もしくは組み合わせて使用されることがあります。
局所療法の活用
皮膚リーシュマニア症の一部の症例では局所療法が選択されることもあります。
局所療法の利点は全身への薬剤負荷を軽減しつつ病変部位に直接作用させることです。
主な局所療法には次のようなものがあります。
- 局所用五価アンチモン製剤
- 局所用パロモマイシン軟膏
- 凍結療法
- 光線力学療法
| 療法 | 適応 | 利点 |
| 局所用五価アンチモン | 限局性皮膚型 | 全身副作用が少ない |
| 凍結療法 | 小型の皮膚病変 | 簡便 低コスト |
| 光線力学療法 | 表在性病変 | 非侵襲的 |
これらの局所療法は病変の大きさ・数・部位などを考慮して選択されます。
内臓リーシュマニア症の治療
内臓リーシュマニア症は最も重篤な病型であり迅速かつ強力な治療が必要です。
主に入院管理下で静脈内投与による全身療法が行われます。
内臓リーシュマニア症の治療で用いられる主な薬剤とその特徴は以下の通りです。
- リポソーマルアムホテリシンB 高い有効性と比較的低い毒性
- 五価アンチモン製剤 従来からの標準的治療薬
- ミルテホシン 経口投与が可能な新しい薬剤
| 薬剤 | 投与期間 | 主な副作用 |
| リポソーマルアムホテリシンB | 3〜5日間 | 腎機能障害・電解質異常 |
| 五価アンチモン製剤 | 28〜30日間 | 心毒性・肝毒性 |
| ミルテホシン | 28日間 | 消化器症状・腎機能障害 |
治療効果は臨床症状の改善や血液検査結果を指標に評価されます。
粘膜皮膚リーシュマニア症の治療
粘膜皮膚リーシュマニア症は 治療が難しく長期間の管理を要することも少なくありません。
全身療法が基本となりますが局所療法を併用することもあります。
粘膜皮膚リーシュマニア症の治療における主な選択肢は以下の通りです。
- 五価アンチモン製剤の長期投与
- リポソーマルアムホテリシンBの間欠投与
- ミルテホシンの経口投与
- 局所療法との併用
| 治療法 | 特徴 | 課題 |
| 五価アンチモン長期投与 | 従来の標準治療 | 副作用リスク |
| アムホテリシンB間欠投与 | 副作用軽減 | 高コスト |
| ミルテホシン経口投与 | 通院治療可能 | 長期服用の遵守性 |
治療期間は数週間から数か月に及ぶことがあり、定期的な経過観察が大切です。
治癒までの期間と経過観察
リーシュマニア症の治癒までの期間は病型・重症度・個人の免疫状態などによって大きく異なります。
一般的な治癒までの期間の目安は次の通りです。
| 病型 | 治療期間 | 経過観察期間 |
| 皮膚型 | 3〜4週間 | 3〜6か月 |
| 内臓型 | 4〜6週間 | 6か月〜1年 |
| 粘膜皮膚型 | 数か月〜1年以上 | 1年以上 |
2019年にブラジルで行われた研究では粘膜皮膚リーシュマニア症患者さんの約70%が6か月以内に臨床的治癒に至りました。
しかし残りの患者さんでは1年以上の治療期間を要したことが報告されています。
治療効果の判定には次のような指標が用いられます。
- 臨床症状の改善
- 血液検査値の正常化
- 画像所見の改善
- 病原体の検出の有無
治療後も定期的な経過観察をすることで再発や合併症の早期発見に努めます。

治療の副作用とリスク
リーシュマニア症の治療には様々な薬剤が用いられますがそれぞれに特有の副作用やリスクが存在し、決して軽視できるものではありません。
しかしながらこれらの多くは適切な管理と対策により軽減もしくは回避することが可能です。
ここでは主要な治療薬の副作用・その管理方法・治療に伴う潜在的なデメリットについて詳しく解説します。
五価アンチモン製剤の副作用
五価アンチモン製剤はリーシュマニア症治療の中心的な薬剤ですが 様々な副作用が報告されています。
この薬剤の使用には慎重なモニタリングが必要です。
主な副作用には次のようなものがあります。
- 心血管系副作用 心電図異常・不整脈
- 消化器症状 悪心・嘔吐・食欲不振
- 筋骨格系症状 筋肉痛・関節痛
- 肝機能障害
- 腎機能障害
| 副作用 | 発現頻度 | 対処法 |
| 心電図異常 | 30-60% | 定期的な心電図検査 |
| 肝機能障害 | 50-70% | 肝機能検査のモニタリング |
| 腎機能障害 | 15-30% | 腎機能検査と水分管理 |
これらの副作用は投与量・期間・患者さんの全身状態によって発現リスクが変化します。
アムホテリシンBの副作用
リポソーマルアムホテリシンBは高い有効性を持つ一方で特有の副作用プロファイルを有します。
この薬剤の使用には注意深い観察と適切な対応が重要です。
アムホテリシンBの主な副作用には次のようなものがあります。
- 腎機能障害
- 電解質異常 特にカリウム・マグネシウムの低下
- 注入反応 発熱・悪寒・頭痛
- 貧血
- 肝機能障害
| 副作用 | 発現時期 | 管理方法 |
| 腎機能障害 | 投与開始後数日〜1週間 | 腎機能検査と投与量調整 |
| 電解質異常 | 投与期間中持続的 | 定期的な電解質測定と補正 |
| 注入反応 | 投与中〜投与直後 | 前投薬・投与速度の調整 |
これらの副作用の多くは投与方法の工夫や支持療法により管理可能です。
ミルテホシンの副作用
経口薬であるミルテホシンは比較的新しい薬剤ですが独特の副作用プロファイルを持っています。
長期間の服用が必要なため副作用の管理が治療継続の鍵となります。
ミルテホシンの主な副作用は次の通りです。
- 消化器症状 悪心・嘔吐・下痢
- 肝機能障害
- 腎機能障害
- 生殖毒性
| 副作用 | 特徴 | 注意点 |
| 消化器症状 | 高頻度だが一過性 | 食事と共に服用・対症療法 |
| 肝機能障害 | 可逆性 | 定期的な肝機能検査 |
| 生殖毒性 | 催奇形性の可能性 | 妊娠可能年齢での使用制限 |
これらの副作用は服薬アドヒアランスに影響を与える可能性があるため患者さん教育と綿密なフォローアップが重要です。
局所療法の副作用とリスク
皮膚リーシュマニア症に対する局所療法は全身療法に比べて副作用が少ないものの、いくつかの注意点があります。
以下は局所療法に伴う主なリスクです。
- 局所の疼痛や腫脹
- 感染リスクの増加
- 瘢痕形成
- 色素沈着異常
| 療法 | 主なリスク | 対策 |
| 局所用五価アンチモン | 注射部位の疼痛・腫脹 | 局所麻酔の併用 |
| 凍結療法 | 水疱形成・色素脱失 | 適切な凍結時間の遵守 |
| 光線力学療法 | 局所の紅斑・浮腫 | 遮光管理・冷却 |
これらのリスクは施術者の技術や患者さんの皮膚状態によって変動するため個別化された管理が必要です。
長期治療に伴うデメリット
リーシュマニア症の治療 特に内臓型や粘膜皮膚型では長期間の薬物療法が必要となることがあります。
この長期治療に伴う潜在的なデメリットは次のようなものです。
- 薬剤耐性菌の出現リスク
- 経済的負担の増大
- QOLの低下
- 社会生活への影響
| デメリット | 影響 | 対応策 |
| 薬剤耐性 | 治療効果の減弱 | 適切な投与量と期間の遵守 |
| 経済的負担 | 治療中断のリスク | 医療費支援制度の活用 |
| QOL低下 | 精神的ストレス | 心理的サポートの提供 |
これらのデメリットを最小限に抑えるためには 包括的な患者さん支援体制が大切です。

リーシュマニア症治療の費用負担
リーシュマニア症の治療費は使用する薬剤や治療期間によって大きく異なります。
ここでは薬価、月間治療費、長期治療時の費用について解説します。
処方薬の薬価
リーシュマニア症治療に用いる薬剤の価格は一般的な感染症治療薬と比べて高額です。
五価アンチモン製剤やリポソーマルアムホテリシンBは1回の投与あたり数万円程度かかります。
| 薬剤名 | 1回投与あたりの薬価 |
| 五価アンチモン製剤 | 本邦では保険収載なし |
| リポソーマルアムホテリシンB | 34,413円 |
1か月の治療費
月間の治療費は病型や重症度によって変動します。
リポソーマルアムホテリシンBにて体重60kgの方を治療する場合、1ヶ月で7日投与するため、総額240,891円となります。
内臓リーシュマニア症の場合では入院治療を要するため薬剤費に加えて入院費や検査費用が発生し、1か月で数十万円を超えることもあります。
治療が長期に渡った場合の治療費
粘膜皮膚リーシュマニア症など長期治療を要する場合の総治療費は百万円を超えてくる可能性があります。
次のような要因が長期治療時の費用増加に関与してくるでしょう。
- 複数回の入院
- 定期的な外来受診と検査
- 継続的な薬物療法
ただし、日本では民間医療保険や高額療養制度などの医療費削減の方法がいくつもあり、検討されるべきです。
なお、上記の価格は2024年10月時点のものであり、最新の価格については随時ご確認ください。
以上

- 参考にした論文