内分泌疾患の一種である原発性アルドステロン症(PA)とは、副腎(ふくじん)という臓器から過剰にアルドステロンというホルモンが分泌される病気です。
このホルモンは体内の塩分と水分のバランスを調整する重要な役割を担っていますが、過剰に分泌されると血圧の上昇や低カリウム血症などの症状を引き起こす可能性があります。
原発性アルドステロン症は高血圧の方のに比較的多く見られる疾患であり、早期発見と適切な対応が大切です。
PAの病型について
病型の主な分類
原発性アルドステロン症(PA)の病型は主にアルドステロン産生腺腫(APA)と特発性アルドステロン症(IHA)の2つに大別されます。
これらの病型はアルドステロンの過剰分泌のメカニズムや発生部位が異なることから、診断や治療方針の決定において重要な役割を果たすのです。
両者の特徴を理解することで適切な対応が可能となり、患者さんの生活の質の向上につながる可能性があります。
アルドステロン産生腺腫(APA)の特徴
アルドステロン産生腺腫(APA)は副腎に良性の腫瘍が発生し、そこからアルドステロンが過剰に分泌される病態です。
この腫瘍は通常片側の副腎に発生し、大きさは1〜3cm程度であることが多いとされています。
APAは原発性アルドステロン症全体の約30〜40%を占めると考えられており、比較的若い年齢層に多く見られる傾向です。
| 特徴 | 詳細 |
| 発生部位 | 片側副腎 |
| 腫瘍の大きさ | 1〜3cm程度 |
| 発症年齢 | 比較的若年層 |
| PA全体での割合 | 30〜40% |
APAの場合は腫瘍からのアルドステロン分泌が自律的に行われるため、レニン-アンジオテンシン系による調節を受けにくいという特徴があります。
このことは診断や病態の理解において重要な点です。
特発性アルドステロン症(IHA)の特徴
特発性アルドステロン症(IHA)は両側の副腎からアルドステロンが過剰に分泌される病態です。
IHAは原発性アルドステロン症の中で最も頻度が高く、全体の60〜70%を占めると考えられています。
APAと比較すると、IHAは比較的高齢者に多く見られる傾向です。
| 特徴 | 詳細 |
| 発生部位 | 両側副腎 |
| 腫瘍の有無 | なし(過形成) |
| 発症年齢 | 比較的高齢者 |
| PA全体での割合 | 60〜70% |
IHAの場合は両側副腎の過形成によりアルドステロンが過剰に分泌されますが、APAと異なってある程度レニン-アンジオテンシン系による調節を受けることができます。
そのためAPAに比べてアルドステロンの分泌パターンが変動しやすいという特徴があります。
病型鑑別の意義
原発性アルドステロン症の病型を正確に鑑別することは以下の理由から大切です。
- 治療方針の決定
- 予後の予測
- フォローアップ計画の立案
- 患者さんへの説明や生活指導
特にAPAとIHAの鑑別は治療法の選択に直結するため、慎重かつ正確に行う必要があります。
| 病型 | APA | IHA |
| 主な治療方針 | 外科的治療 | 内科的治療 |
| 予後 | 比較的良好 | 長期管理が必要 |
病型の鑑別には画像検査や副腎静脈サンプリングなどの特殊検査が用いられますが、これらの検査の実施には専門的な知識と技術が必要なのです。
また、病型によって経過観察の方法や頻度も異なることがあるため、専門医による継続的なフォローアップが重要です。
その他の稀な病型
APAとIHA以外にも原発性アルドステロン症には以下のような稀な病型が存在します。
- 片側性副腎過形成
- 副腎癌によるアルドステロン過剰分泌
- グルココルチコイド反応性アルドステロン症
これらの稀な病型は診断や治療法が標準的なAPAやIHAとは異なる場合があるため、専門医による詳細な評価が不可欠です。
原発性アルドステロン症の病型は多様であり、それぞれの特徴を理解することでさらに適切な診断と対応が可能となります。
患者さん一人一人の状況に応じた最適なアプローチを選択するためにも病型の正確な鑑別と専門医による総合的な評価が重要な役割を果たすのです。

主症状を理解する
高血圧症状の特徴
原発性アルドステロン症の最も顕著な症状は持続的な高血圧です。
この高血圧はアルドステロンホルモンの過剰分泌によって引き起こされ、通常の高血圧治療薬に対して抵抗性を示すことがあります。
患者さんの中には若年期から高血圧を発症する方もおり、家族歴がない場合でも注意が必要です。
| 高血圧の特徴 | 詳細 |
| 発症年齢 | 比較的若年でも可能 |
| 薬剤反応性 | 治療抵抗性のことが多い |
| 日内変動 | 夜間も高値が持続しやすい |
| 合併症リスク | 心血管系への影響が大きい |
高血圧が長期間続くと心臓や血管系に負担がかかり、様々な合併症のリスクが高まる可能性があります。
そのため原発性アルドステロン症を早期に発見し、適切に対応することが重要です。
低カリウム血症に関連する症状
原発性アルドステロン症のもう一つの主要な症状は、低カリウム血症に関連するものです。
アルドステロンの過剰分泌によって腎臓からのカリウム排泄が促進され、血中のカリウム濃度が低下します。
低カリウム血症によって引き起こされる可能性のある症状は以下ののようなものです。
| 低カリウム血症の症状 | 発現部位 |
| 筋力低下 | 四肢筋肉 |
| 不整脈 | 心臓 |
| 便秘 | 消化管 |
| 倦怠感 | 全身 |
ただし、すべての患者さんが低カリウム血症を呈するわけではありません。
特に特発性アルドステロン症(IHA)の場合は正常範囲内のカリウム値を示すこともあるため、注意が必要です。
全身症状と生活への影響
原発性アルドステロン症は高血圧や低カリウム血症以外にも様々な全身症状を引き起こす可能性があります。
これらの症状は患者さんの日常生活に大きな影響を与えることがあるでしょう。
主な全身症状には以下のようなものです。
- 頭痛
- めまい
- 視力障害
- 耳鳴り
- 息切れ
- 動悸
- 夜間頻尿
上記のような症状は高血圧や低カリウム血症の直接的な影響だけでなく、長期的な病態の進行によっても引き起こされる可能性があります。
| 症状 | 関連する病態 |
| 頭痛 | 高血圧 |
| 視力障害 | 高血圧による網膜症 |
| 息切れ | 心機能低下 |
| 夜間頻尿 | 心不全、腎機能低下 |
患者さんによってはこれらの症状により日常生活や仕事に支障をきたすこともあるため、早期発見と適切な対応が大切です。
無症状の場合と潜在的リスク
原発性アルドステロン症の患者さんの中には明確な症状を自覚しない方もいます。
これは高血圧や低カリウム血症が徐々に進行し、体が適応してしまうためです。
しかし症状がなくても、長期的には以下のような合併症のリスクが高まる可能性があります。
- 心血管疾患
- 脳血管疾患
- 腎機能障害
- 代謝異常
| 無症状でも注意すべき点 | 理由 |
| 定期的な健康診断 | 早期発見のため |
| 血圧の自己測定 | 変動の把握 |
| 生活習慣の見直し | リスク軽減 |
| 家族歴の確認 | 遺伝的要因の考慮 |
無症状であっても高血圧や家族歴などのリスク要因がある場合は専門医への相談を考慮することが望ましいでしょう。
症状の経時的変化と進行
原発性アルドステロン症の症状は時間とともに変化し、進行する傾向です。
初期段階では軽微な症状しか現れないこともありますが、病態が進行するにつれて症状が顕在化したり悪化したりすることがあります。
以下は経時的変化が観察される例です。
- 血圧の上昇傾向
- カリウム値の低下
- 心血管系への負担の増加
- 腎機能の徐々な低下
原発性アルドステロン症の症状は多岐にわたり、個人差も大きいです。
高血圧や低カリウム血症といった主要症状だけでなく、全身に及ぶ様々な症状にも注意を払う必要があります。
また、無症状の場合でも潜在的なリスクがあることを認識し、適切な医療機関での定期的なチェックを受けることが重要です。
症状の早期発見と適切な対応によって生活の質を維持しつつ、長期的な健康リスクを軽減できる可能性があります。

原因とそのメカニズムを探る
副腎におけるホルモン分泌の異常
原発性アルドステロン症(PA)は副腎からのアルドステロンホルモンの過剰分泌が根本的な原因です。
この異常な分泌は副腎の機能に直接関わる様々な要因によって引き起こされる可能性があります。
アルドステロンは通常、体内の塩分バランスや血圧調整に重要な役割を果たしていますが、PAではこの繊細なバランスが崩れてしまうのです。
| 正常な副腎機能 | PA における異常 |
| 適切なアルドステロン分泌 | 過剰なアルドステロン分泌 |
| レニン-アンジオテンシン系による調節 | 調節機能の低下または喪失 |
| 電解質バランスの維持 | 電解質バランスの乱れ |
| 正常な血圧調整 | 持続的な血圧上昇 |
副腎の機能異常は遺伝的要因や後天的な変化によって引き起こされることがありますが、その詳細なメカニズムについてはまだ完全には解明されていません。
アルドステロン産生腺腫の形成要因
アルドステロン産生腺腫(APA)は原発性アルドステロン症の主要な原因の一つです。
この良性腫瘍は副腎皮質の球状層に発生して自律的にアルドステロンを産生します。
APAの形成には以下のような要因が関与している可能性があるのです。
- 遺伝子変異(KCNJ5、ATP1A1、ATP2B3、CACNA1Dなど)
- 細胞増殖シグナルの異常
- ホルモン受容体の機能異常
- 細胞内カルシウム調節の乱れ
これらの要因が単独または複合的に作用することで腫瘍細胞の増殖とアルドステロンの過剰産生が引き起こされると考えられています。
| 遺伝子 | 関連する機能 |
| KCNJ5 | カリウムチャネル |
| ATP1A1 | ナトリウム-カリウムポンプ |
| ATP2B3 | カルシウムポンプ |
| CACNA1D | カルシウムチャネル |
これらの遺伝子変異は細胞内のイオンバランスや細胞膜の電位を変化させ、結果としてアルドステロンの過剰産生につながると考えられているのです。
特発性アルドステロン症の発症機序
特発性アルドステロン症(IHA)は両側の副腎が過形成を起こし、アルドステロンを過剰に分泌する状態です。
IHAの発症機序はAPAと比べてより複雑でまだ不明な点が多く残されていますが、次のような要因が関与していると考えられています。
- 副腎皮質刺激ホルモン(ACTH)への過剰反応
- アンジオテンシンII受容体の感受性亢進
- 副腎皮質細胞の増殖因子の異常
- 遺伝的素因
これらの要因が複雑に絡み合い、両側副腎の過形成とアルドステロンの過剰分泌を引き起こしている可能性があります。
| IHAの特徴 | 詳細 |
| 発症部位 | 両側副腎 |
| 形態変化 | びまん性過形成 |
| アルドステロン分泌 | 比較的変動性あり |
| 年齢層 | 幅広い(高齢者に多い傾向) |
IHAの場合はAPAと異なり、レニン-アンジオテンシン系による調節をある程度受けることができるためアルドステロン分泌のパターンがより複雑になる傾向です。
遺伝的要因と家族性原発性アルドステロン症
原発性アルドステロン症の中には遺伝的要因が強く関与するタイプが存在します。
これらは家族性原発性アルドステロン症として知られており、特定の遺伝子変異が世代を超えて受け継がれることで発症するのです。
主な家族性原発性アルドステロン症には以下のようなものがあります。
- 家族性高アルドステロン症I型(グルココルチコイド反応性アルドステロン症)
- 家族性高アルドステロン症II型
- 家族性高アルドステロン症III型
- 家族性高アルドステロン症IV型
| 家族性PA型 | 主な原因遺伝子 |
| I型 | CYP11B1/CYP11B2キメラ遺伝子 |
| II型 | 不明(複数の候補遺伝子) |
| III型 | KCNJ5遺伝子 |
| IV型 | CACNA1H遺伝子 |
これらの遺伝的変異はアルドステロン合成経路や副腎細胞の機能に直接影響を与え、結果としてアルドステロンの過剰産生を引き起こします。
家族性原発性アルドステロン症の研究はPAの発症メカニズムの理解を深める上で重要な役割を果たしているのです。
環境因子と生活習慣の影響
原発性アルドステロン症の発症には遺伝的要因や副腎の内在的な変化だけでなく、環境因子や生活習慣も影響を与える可能性があります。
これらの外的要因は直接的にPAを引き起こすわけではありませんが、発症のリスクを高めたり病態の進行を加速させたりする可能性があるのです。
考慮すべき環境因子や生活習慣は次の通りです。
| 要因 | 潜在的な影響 |
| 塩分過剰摂取 | レニン-アンジオテンシン系の活性化 |
| 慢性ストレス | 副腎皮質刺激ホルモンの分泌増加 |
| 肥満 | インスリン抵抗性とアルドステロン分泌の関連 |
| 運動不足 | 血圧調整機能の低下 |
これらの因子が副腎の機能や全身の代謝状態に影響を与えることで、PAの発症や進行に関与している可能性が生じます。
以上のように原発性アルドステロン症の原因は複雑で多岐にわたります。
遺伝子変異、副腎の形態学的変化、ホルモン調節系の異常、さらには環境因子や生活習慣まで様々な要素が絡み合って発症に至ると考えられています。

PAの診察と診断プロセス
初期スクリーニングと問診の重要性
原発性アルドステロン症の診断は詳細な問診から始まり、患者さんの症状や家族歴、生活習慣などについて丁寧な聞き取りを行います。
この初期段階での情報収集がその後の診断プロセスの方向性を決める上で大切です。
| 問診項目 | 着目点 |
| 高血圧の経過 | 発症年齢、程度、変動 |
| 家族歴 | 高血圧、内分泌疾患の有無 |
| 生活習慣 | 塩分摂取、ストレス、運動 |
| 薬剤使用歴 | 降圧薬の効果、副作用 |
問診に加えて血圧測定や身体診察も行われます。特に血圧の日内変動や姿勢による変化にも注意を払わなければなりません。
血液検査による生化学的評価
PAの診断において血液検査は非常に重要な役割を果たします。
特に血中のアルドステロン濃度(PAC)とレニン活性(PRA)の測定が基本です。
これらの値から算出されるアルドステロン・レニン比(ARR)は、PAのスクリーニングに広く用いられています。
| 検査項目 | 正常値(参考) |
| PAC | 3.0-15.9 ng/dL |
| PRA | 0.3-2.9 ng/mL/hr |
| ARR | <20 |
ARRが高値を示した場合ではPAの可能性が疑われますが、これだけでは確定診断には至りません。その後さらなる精密検査が必要となるのです。
負荷試験による機能評価
ARRが高値を示した患者さんに対しては次のステップとして負荷試験が行われることがあります。これらの試験は体内のホルモン調節系の反応を評価するものです。
主な負荷試験には以下のようなものがあります。
- カプトプリル負荷試験
- 生理食塩水負荷試験
- フロセミド立位負荷試験
- ACTH負荷試験
上記のような試験では特定の薬剤を投与したり、体位を変えたりした際のアルドステロンやレニンの変化を観察します。
正常な反応とPAにおける反応の違いを評価することで診断の精度を高めることが可能です。
画像診断によるPAの局在診断
PAの診断が疑われる場合には次のステップとして画像診断が行われます。
これは主にアルドステロン産生腺腫(APA)と特発性アルドステロン症(IHA)を鑑別するために重要です。
| 画像検査 | 主な目的 |
| CT | 腫瘍の有無、大きさ、位置の確認 |
| MRI | 軟部組織の詳細な評価 |
| シンチグラフィ | 機能的な評価 |
CTやMRIでは副腎の形態学的な変化を観察します。
APAの場合の多くは1〜2cm程度の腫瘤として描出されますが、小さな腫瘍は見逃される可能性もあります。
一方、IHAでは両側副腎の軽度腫大や正常所見を呈することがあるでしょう。
副腎静脈サンプリングの役割
画像診断だけでは鑑別が困難な場合、副腎静脈サンプリング(AVS)が行われることがあります。
これは両側の副腎静脈から直接血液を採取し、アルドステロン濃度を測定する検査です。
AVSはPAの病型診断において最も信頼性の高い方法とされています。
| AVSの利点 | AVSの課題 |
| 高い診断精度 | 技術的難易度 |
| 片側・両側の鑑別 | 侵襲的手技 |
| 微小腫瘍の検出 | 施設間差の存在 |
AVSによってAPAとIHAの鑑別だけでなく、APAの場合はその局在も正確に把握することが可能です。
ただしこの検査は高度な技術を要するため、経験豊富な専門医による実施が望ましいとされています。
総合的な診断アプローチの必要性
PAの診断は単一の検査結果だけで判断することはできません。
以下のような複数の検査結果を総合的に評価することが重要です。
- 血液生化学検査
- 画像診断
- 負荷試験
- AVS(必要な場合)
これらの結果を専門医が慎重に検討してから総合的な判断を下します。
| 診断ステップ | 主な目的 |
| スクリーニング | PAの可能性の評価 |
| 確認検査 | PA診断の確定 |
| 局在診断 | 病型(APA/IHA)の鑑別 |
| 最終診断 | 治療方針の決定 |
PAの診断プロセスは複雑で時間がかかることがありますが、正確な診断は適切な対応につながるため大切なステップと言えます。

PAの画像所見を読み解く
CTによる副腎の形態評価
原発性アルドステロン症(PA)の画像診断において、CTは非常に重要な役割を果たします。
CTを用いることで副腎の形態や大きさ、周囲組織との関係を詳細に観察することが可能です。
アルドステロン産生腺腫(APA)の場合、多くは直径1〜2cm程度の円形または楕円形の腫瘤として描出されます。
| CT所見 | APA | IHA |
| 腫瘤の有無 | あり(片側) | なし、または両側に小結節 |
| 副腎の大きさ | 片側腫大 | 正常〜両側びまん性腫大 |
| 造影効果 | 軽度〜中等度 | 通常は均一 |
特発性アルドステロン症(IHA)では両側副腎のびまん性腫大や正常所見を呈することが多く、明確な腫瘤は認められないことが特徴です。
ただし小さなAPAはCTで検出できない場合もあるため、注意が必要です。
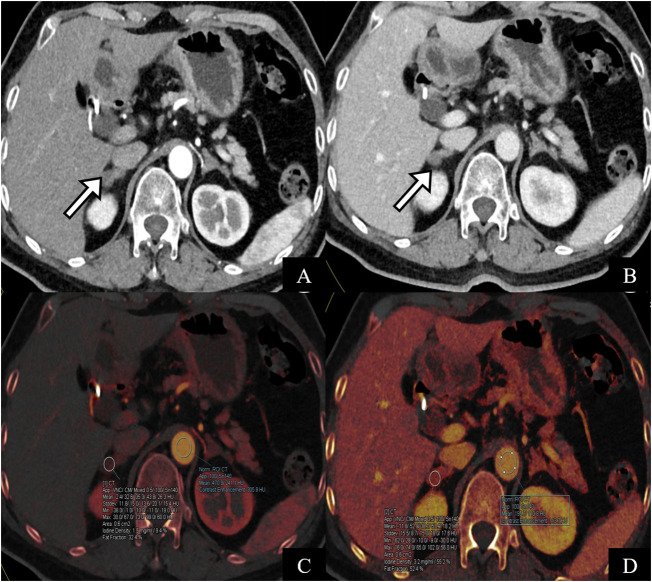
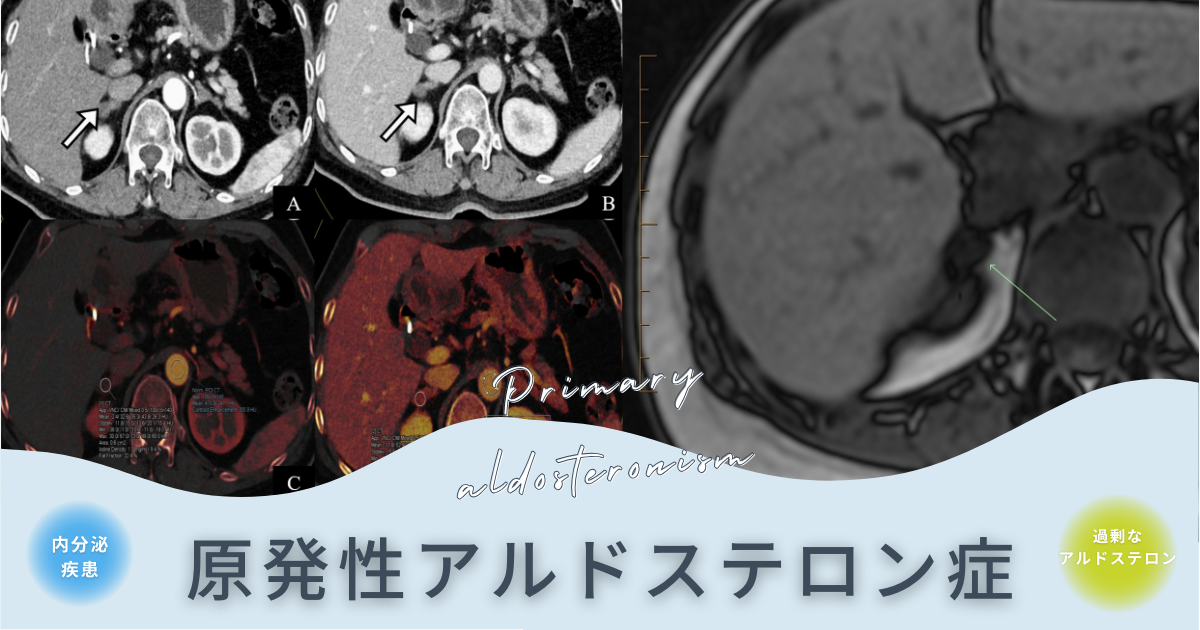
所見:64歳の女性患者で、手術および病理学的に原発性アルドステロン症が確認された症例。(A, B) 副腎のCTスキャンでは、両側の副腎が結節性の軟部組織密度を示している(白矢印)。 AVS(副腎静脈サンプリング)により、右側で高アルドステロン分泌が示された。 (C, D) 動脈相のヨードマップ。動脈相および静脈相でのヨード濃度はそれぞれ1.7 mg/mlおよび0.61 mg/mlであり、ICD(ヨード濃度差)は1.09 mg/mlであった。これらの所見は、AVSの右優位側の診断と一致している。
MRIによる軟部組織の詳細評価
MRIはCTと比較してより優れた軟部組織のコントラスト分解能を持ちます。
そのため副腎の内部構造や周囲組織との関係を詳細に観察することができるのです。
APAはT1強調像で低信号、T2強調像で高信号を示すことが多いです。
| MRI撮像法 | APA所見 | IHA所見 |
| T1強調像 | 低信号 | 正常〜やや低信号 |
| T2強調像 | 高信号 | 正常〜軽度高信号 |
| 造影後 | 早期濃染 | びまん性増強 |
MRIでは化学シフト法を用いることで腫瘤内の脂肪成分を評価することもできます。これは良性腺腫と悪性腫瘍の鑑別に役立つでしょう。
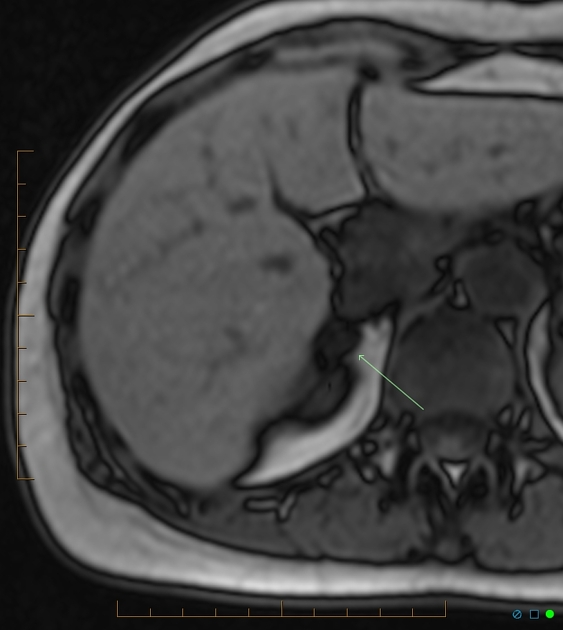
所見:右副腎に約1 cmの脂肪含有腫瘤を認める。
副腎シンチグラフィによる機能評価
副腎シンチグラフィは形態学的評価だけでなく、副腎の機能を評価することができる画像診断法です。
131I-アドステロールや11C-メトミデートなどの放射性トレーサーを用いてアルドステロン産生組織を可視化します。
APAの場合は腫瘍に一致して強い集積が見られます。一方、IHAでは両側副腎に均一な集積が観察されることが多いです。
| シンチグラフィ所見 | APA | IHA |
| 集積パターン | 片側強集積 | 両側均一集積 |
| 対側抑制 | あり | なし |
| 集積の強さ | 強い | 中等度 |
シンチグラフィは特に小さなAPAの検出や、CTやMRIで明確な腫瘤が認められない場合の機能評価に有用です。
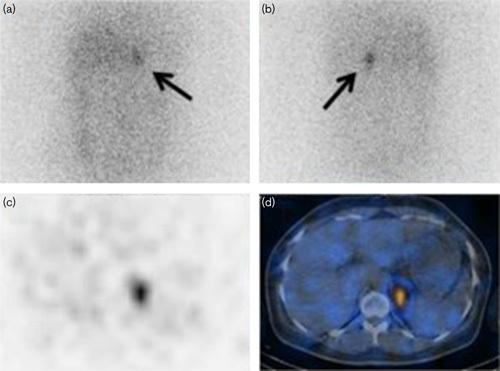
所見:45歳の高血圧および低カリウム血症を呈する女性患者。(a) 前面および(b) 後面の平面ヨウ素-131 6-ベータ-ヨードメチル-19-ノルコレステロール画像では、左副腎における放射性トレーサーの集積が示されている(矢印)。 (c) 単一光子放出コンピュータ断層撮影(SPECT)および(d) 単一光子放出コンピュータ断層撮影-コンピュータ断層撮影(SPECT-CT)画像では、左副腎に強い集積と3.5 cmの腫瘍が認められ、左副腎腺腫と一致している。
PET-CTによる高精度な機能・形態評価
PET-CTは形態学的情報と機能的情報を同時に得ることができる先進的な画像診断法です。
11C-メトミデートなどの特異的トレーサーを用いることでアルドステロン産生組織を高精度に検出することができます。
PET-CTの利点として以下が挙げられます。
- 高い空間分解能
- 定量的評価が可能
- 全身スキャンによる異所性病変の検索
| PET-CT評価項目 | APA | IHA |
| SUV値 | 高値(片側) | 中等度(両側) |
| 集積パターン | 限局性 | びまん性 |
| 対側抑制 | 明瞭 | 不明瞭 |
PET-CTは特に小さなAPAの検出や多発性病変の評価に優れています。
ただし高コストや限られた施設でしか実施できないといった課題もあるのが実情です。
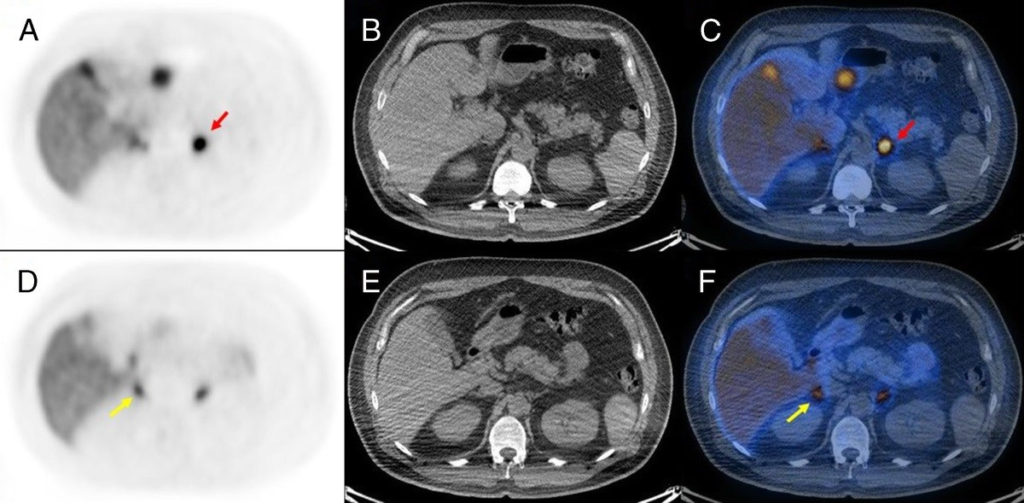
所見:副腎静脈サンプリング(AVS)の結果に基づき、右副腎摘出術を受けた(LI, 189; 右)。しかし、術後の生化学的改善は見られなかった。11C-メトミデートPETでは、左副腎に強い集積が認められた(左副腎:A–C、赤矢印、SUVmax = 14.2; 右副腎:D–F、黄色矢印、SUVmax = 6.7; CON = 2.12)。
画像所見の総合的解釈の重要性
PAの画像診断においては単一の検査結果だけでなく、複数の画像所見を総合的に解釈することが大切です。
以下のような点に注意して画像を評価することが望ましいでしょう。
- 腫瘤の有無と性状
- 副腎全体の形態と大きさ
- 造影パターンや信号強度の特徴
- 機能的集積の程度と分布
| 評価ポイント | APA | IHA |
| 形態 | 限局性腫瘤 | びまん性腫大 |
| 片側性/両側性 | 片側 | 両側 |
| 機能的集積 | 強い(片側) | 中等度(両側) |
| 対側抑制 | あり | なし |
これらの所見を総合的に判断することでAPAとIHAの鑑別精度を高めることができます。
原発性アルドステロン症(PA)の画像所見は病型によって特徴的なパターンを示します。
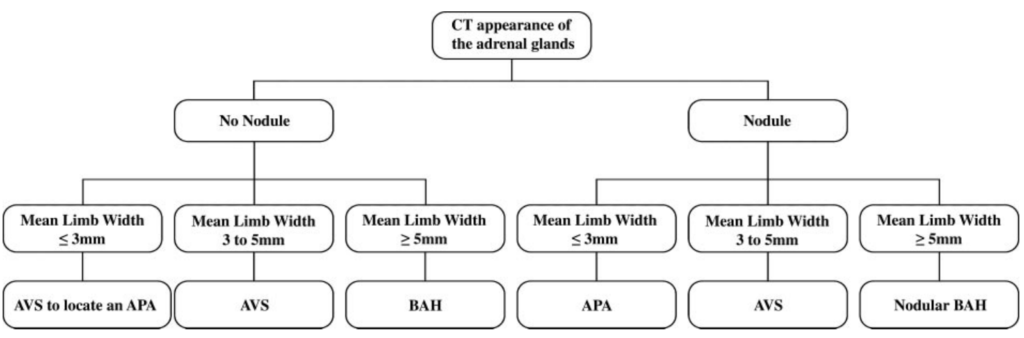
所見:「Lingamら(38)は、副腎辺縁幅測定に基づき、両側副腎過形成(BAH)とアルドステロン産生腺腫(APA)を鑑別する診断アルゴリズムを提案し、検証を行った。本アルゴリズムを用いた小規模研究(28例)では、平均副腎辺縁幅が5mm以上でBAHの診断に対する特異度100%、3mm以上で感度100%を達成した。しかし、28例中13例(46%)では副腎幅が両閾値の間にあり、副腎静脈サンプリング(AVS)が必要であった。そのため、本アルゴリズムの検証にはより大規模な研究が必要であると示唆されている。」

治療法と回復への道のり
CT、MRI、シンチグラフィ、PET-CTなど各種画像診断法の特性を理解し、適切に組み合わせることが重要です。
治療方針の決定プロセス
PAの治療方針は病型や患者さんの状態に応じて個別に決定されます。
アルドステロン産生腺腫(APA)と特発性アルドステロン症(IHA)では基本的な治療アプローチが異なります。
治療方針の決定において考慮される要素は以下の通りです。
- 病型(APAかIHAか)
- 患者さんの年齢と全身状態
- 合併症の有無と程度
- 患者さんの希望
| 病型 | 主な治療方針 |
| APA | 外科的治療(腹腔鏡下副腎摘除術) |
| IHA | 内科的治療(薬物療法) |
治療方針の決定は内分泌専門医、外科医、放射線科医などの多職種チームによる検討を経て行われることが多いでしょう。
外科的治療(腹腔鏡下副腎摘除術)
APAに対する標準的な治療は腹腔鏡下副腎摘除術です。この手術は小さな切開創から特殊な器具を用いて行われ、従来の開腹手術と比べて低侵襲です。
手術の利点として以下が挙げられます。
- アルドステロン過剰分泌の根本的な解決
- 血圧改善の可能性が高い
- 長期的な薬物療法が不要になる可能性
| 手術関連項目 | 詳細 |
| 手術時間 | 約2〜3時間 |
| 入院期間 | 5〜7日程度 |
| 合併症率 | 低い(経験豊富な施設で) |
手術後は一時的にステロイドホルモンの補充が必要になることがあります。また、退院後も定期的な経過観察が重要です。
内科的治療(薬物療法)
IHAや手術が適さないAPAの患者さんに対しては薬物療法が主な治療法となります。主に使用される薬剤はミネラルコルチコイド受容体拮抗薬(MRA)です。
代表的なMRAには以下のものがあります。
- スピロノラクトン
- エプレレノン
これらの薬剤はアルドステロンの作用を阻害することで血圧の制御や電解質バランスの改善を図ります。
| 薬剤名 | 特徴 |
| スピロノラクトン | 強力だが副作用に注意 |
| エプレレノン | 選択性が高く副作用が少ない |
MRAに加えて必要に応じて他の降圧薬(カルシウム拮抗薬やACE阻害薬など)が併用されることもあるでしょう。
生活習慣の改善と長期的なフォローアップ
薬物療法や手術と並行して生活習慣の改善も重要な治療の一環で、特に以下の点に注意が必要です。
- 減塩食の実践
- 適度な運動
- ストレス管理
- 禁煙
これらの生活習慣改善は薬物療法の効果を高め、長期的な予後改善につながる可能性があります。
| 生活習慣改善項目 | 目標 |
| 食塩摂取量 | 6g/日未満 |
| 運動 | 週150分以上の中等度運動 |
| 体重 | BMI 25未満 |
| アルコール | 適度な摂取(過剰を避ける) |
長期的なフォローアップでは定期的な血圧測定、血液検査、心臓や腎臓の機能評価などが行われるのが一般的です。
治癒までの期間と経過観察
PAの「治癒」という概念は病型や治療法によって異なります。
APAで手術を受けた場合には多くの患者さんで手術直後から劇的な改善が見られます。ただし完全な回復には時間がかかることもあるでしょう。
| 経過期間 | 期待される変化 |
| 手術直後 | アルドステロン値の正常化 |
| 数週間〜数ヶ月 | 血圧の安定化、電解質バランスの改善 |
| 6ヶ月〜1年 | 心血管系や腎機能の改善傾向 |
一方、IHAや薬物療法を選択したAPAの場合は「治癒」というより「コントロール」という表現が適切です。
薬物療法は長期的な継続が必要で、定期的な用量調整や薬剤変更が行われることがあります。
経過観察の頻度は病状の安定度に応じて徐々に減らしていくことが一般的です。

治療における副作用とリスクの理解
薬物療法に伴う副作用
PAの薬物療法では主にミネラルコルチコイド受容体拮抗薬(MRA)が使用されますが、これらの薬剤にも副作用が存在します。
スピロノラクトンとエプレレノンは、それぞれ異なる副作用プロファイルを持っています。
スピロノラクトンの主な副作用には以下のようなものが考えられるのです。
| 副作用 | 発生頻度 |
| 女性化乳房 | 約10% |
| 性欲減退 | 5〜10% |
| 胃腸障害 | 2〜5% |
一方、エプレレノンはより選択性が高く上記のような副作用は比較的少ないですが、高カリウム血症のリスクには注意が必要です。
薬物療法を長期間継続する必要があるため、これらの副作用のモニタリングと管理が大切です。
外科的治療に伴うリスク
アルドステロン産生腺腫(APA)に対する腹腔鏡下副腎摘除術は一般的に安全な手術ですが、全ての手術と同様にリスクが存在します。
主な手術関連リスクには以下のようなものがあります。
| リスク | 発生頻度 |
| 出血 | 1〜2% |
| 感染 | 1〜3% |
| 臓器損傷 | 1%未満 |
これらのリスクは経験豊富な外科医によって手術が行われることで最小限に抑えられる可能性があります。
また、手術後には一時的にステロイドホルモンの補充が必要になることがあり、これに伴う副作用にも注意が必要です。
治療後の電解質バランスの変動
PAの治療後、特に手術療法を受けた患者さんでは急激な電解質バランスの変動が起こる恐れもあります。
これは長期間高アルドステロン状態にあった体が、急に正常化することで起こる現象です。
主な電解質異常とそのリスクには以下のようなものがあります。
| 電解質異常 | 起こりやすい時期 |
| 低カリウム血症の悪化 | 手術直後 |
| 低ナトリウム血症 | 手術後1〜2週間 |
| 低マグネシウム血症 | 手術後1〜4週間 |
上記の電解質異常は適切な補充療法と注意深いモニタリングによって管理されますが、重度の場合は心臓のリズム異常などの深刻な合併症を引き起こす危険性も秘めているのです。
長期的な合併症リスク
PAの治療は効果的であっても、長期間の高アルドステロン状態による影響が完全に消失するわけではありません。
特に心血管系や腎臓への影響は長期的に持続する可能性があり、次のような長期的なリスクに注意が必要です。
| 合併症 | リスク因子 |
| 心血管イベント(心筋梗塞、脳卒中など) | 高血圧の持続期間、年齢 |
| 慢性腎臓病の進行 | 高血圧の重症度、治療前の腎機能 |
| 骨密度低下 | 長期のステロイド補充 |
これらのリスクを軽減するためには治療後も継続的な経過観察と生活習慣の改善が重要です。
治療抵抗性と再発のリスク
PAの治療は多くの場合効果的ですが、一部の患者さんでは治療抵抗性や再発のリスクがあります。
特発性アルドステロン症(IHA)の場合は薬物療法に対する反応が不十分なことも少なくありません。
また、APAで手術を受けた患者さんの一部でも完全な治癒に至らないケースがあります。
再発や治療抵抗性のリスク因子には次のようなものがあるのです。
- 診断時の高齢
- 長期間の高血圧歴
- 複数の副腎結節の存在
- 不完全な腫瘍摘除
| リスク | APA | IHA |
| 再発率 | 5〜10% | N/A |
| 治療抵抗性 | 10〜20% | 30〜40% |
これらのリスクに対しては定期的な経過観察と必要に応じた治療の調整が重要です。

PAの再発リスクと予防戦略
再発の可能性と要因
PAの再発リスクは病型や治療方法によって異なります。
アルドステロン産生腺腫(APA)の場合で手術後の再発率は比較的低いとされていますが、完全にゼロではありません。
一方、特発性アルドステロン症(IHA)では薬物療法を中断すると症状が再燃する可能性が高くなります。
| 病型 | 再発リスク |
| APA(手術後) | 5-10% |
| IHA(薬物療法中断時) | 50-70% |
以下は再発のリスク要因です。
- 不完全な腫瘍摘除(APA)
- 複数の副腎結節の存在
- 長期間の高血圧歴
- 高齢
これらの要因を持つ患者さんでは、より慎重な経過観察が必要となる可能性があります。
定期的なフォローアップの重要性
PAの再発を早期に発見して適切に対応するためには、定期的なフォローアップが大切です。
フォローアップでは以下のような項目がチェックされます。
- 血圧測定
- 血液検査(電解質、アルドステロン、レニン活性など)
- 尿検査
- 心臓や腎臓の機能評価
| フォローアップ項目 | 頻度 |
| 血圧測定 | 1-3ヶ月ごと |
| 血液検査 | 3-6ヶ月ごと |
| 心臓・腎臓機能評価 | 年1回 |
定期的なフォローアップによって再発の兆候を早期に捉え、迅速な対応を取ることが可能となります。
生活習慣の改善による予防
PAの再発リスクを低減するためには生活習慣の改善が重要な役割を果たします。
特に以下の点に注意を払うことが望ましいでしょう。
- 減塩食の実践
- 適度な運動の継続
- ストレス管理
- 適正体重の維持
- 禁煙
| 生活習慣改善項目 | 目標 |
| 食塩摂取量 | 6g/日未満 |
| 運動 | 週150分以上の中等度運動 |
| BMI | 25未満 |
これらの生活習慣改善はPAの再発予防だけでなく、全身の健康維持にも寄与することが期待されます。
薬物療法の継続と調整
IHAや一部のAPA患者さんでは長期的な薬物療法が必要となります。
薬物療法の継続は再発予防に重要ですが、同時に副作用のモニタリングと用量調整も必要です。
主な注意点として以下が挙げられます。
- 処方された薬剤の規則正しい服用
- 副作用の自己観察と報告
- 定期的な血液検査による電解質バランスのチェック
- 他の薬剤との相互作用への注意
| 薬物療法モニタリング項目 | 頻度 |
| 血圧測定 | 毎日 |
| 副作用チェック | 随時 |
| 血液検査 | 1-3ヶ月ごと |
薬物療法の継続と適切な調整によって長期的な病状のコントロールと再発予防が期待できます。
ストレス管理と心理的サポート
PAの再発予防には身体的な側面だけでなく、心理的な面でのケアも重要です。
慢性疾患であるPAの管理は患者さんに心理的なストレスをもたらすことがあります。
このストレスが病状の悪化や再発のリスクを高める可能性があるため、以下のような取り組みが有効です。
- リラクセーション技法の習得
- カウンセリングや支援グループへの参加
- 趣味や社会活動を通じたストレス解消
- 十分な睡眠の確保
| ストレス管理法 | 効果 |
| 深呼吸法 | 即時的なリラックス |
| 瞑想 | 長期的なストレス耐性向上 |
| 運動 | 気分改善とストレス解消 |
上記のような心理的サポートはPAの再発予防だけでなく患者さんの生活の質の向上にも寄与するでしょう。
このように原発性アルドステロン症の再発は適切な管理と予防策によりリスクを低減でき、良好な予後が期待できるのです。
PAの治療にかかる費用
原発性アルドステロン症の治療費は診断から治療、そして経過観察まで幅広い範囲に及びます。
個々の患者さんの状態や選択する治療法によって大きく異なりますが、一般的に数十万円から数百万円程度の費用が必要となる可能性があります。
初診・再診料
初診料は多くの医療機関で2,910円~5,410円、再診料は750円~2,660円です。
検査費用
血液検査や画像診断の費用は合計で1万円から数万円程度になることがあります。
| 費用項目 | 概算金額 |
| 採血検査 | 4,200円(血液一般+生化学5-7項目の場合) +1,220円(アルドステロン(ALD)) +1,000円(レニン活性(PRA)) |
| MRI検査 | 19,000円~30,200円 |
手術費用
腹腔鏡下副腎摘除術の場合、入院費用を含めて50万円から100万円程度かかる可能性があります。
| 費用項目 | 概算金額 |
| 手術費 | 副腎腫瘍摘出術 1 皮質腫瘍 394,100円 |
| 入院費 | 360,320円 +出来高計算分 |
詳しく説明すると、日本の入院費はDPC(診断群分類包括評価)システムを使用して計算されます。このシステムは、患者の病名や治療内容に基づいて入院費を決定する方法です。以前の「出来高」方式とは異なり、DPCシステムでは多くの診療行為が1日あたりの定額に含まれます。
DPCシステムの主な特徴
- 約1,400の診断群に分類される
- 1日あたりの定額制
- 一部の治療は従来通りの出来高計算が適用される
DPCシステムと出来高計算の比較表
| DPC(1日あたりの定額に含まれる項目) | 出来高計算項目 |
|---|---|
| 投薬 | 手術 |
| 注射 | リハビリ |
| 検査 | 特定の処置 |
| 画像診断 | |
| 入院基本料 |
DPCシステムの計算方法
計算式は以下の通りです:
「1日あたりの金額」×「入院日数」×「医療機関別係数」+「出来高計算分」
*医療機関別係数は各医療機関によって異なります。
例えば、患者が14日間入院した場合の計算は以下のようになります。
DPC名: 副腎皮質機能亢進症、非機能性副腎皮質腫瘍 その他の手術あり 手術処置等2なし
日数: 14
医療機関別係数: 0.0948 (例:神戸大学医学部附属病院)
入院費: ¥360,320 +出来高計算分
保険が適用されると、自己負担額は1割から3割になります。また、高額医療制度の対象となる場合、実際の自己負担額はさらに低くなります。
なお、上記の価格は2024年7月時点のものであり、最新の価格については随時ご確認ください。
薬物療法費用
月々の薬剤費は使用する薬剤によって異なりますが、5,000円から20,000円程度です。
以上