「1型糖尿病はなぜ自分がなったのだろう」「原因と言われる自己抗体って何?」そう疑問に思ったことはありませんか。
1型糖尿病は生活習慣病である2型糖尿病とは異なり、自分自身の免疫システムが関わる病気です。その発症の鍵を握るのが「自己抗体」の存在です。
この記事では1型糖尿病の原因となる自己免疫の仕組みと自己抗体の役割、そして病気の根本にアプローチする治療法として期待される「免疫療法」の現在地について、専門医が分かりやすく解説します。
1型糖尿病の発症原因「自己免疫」とは
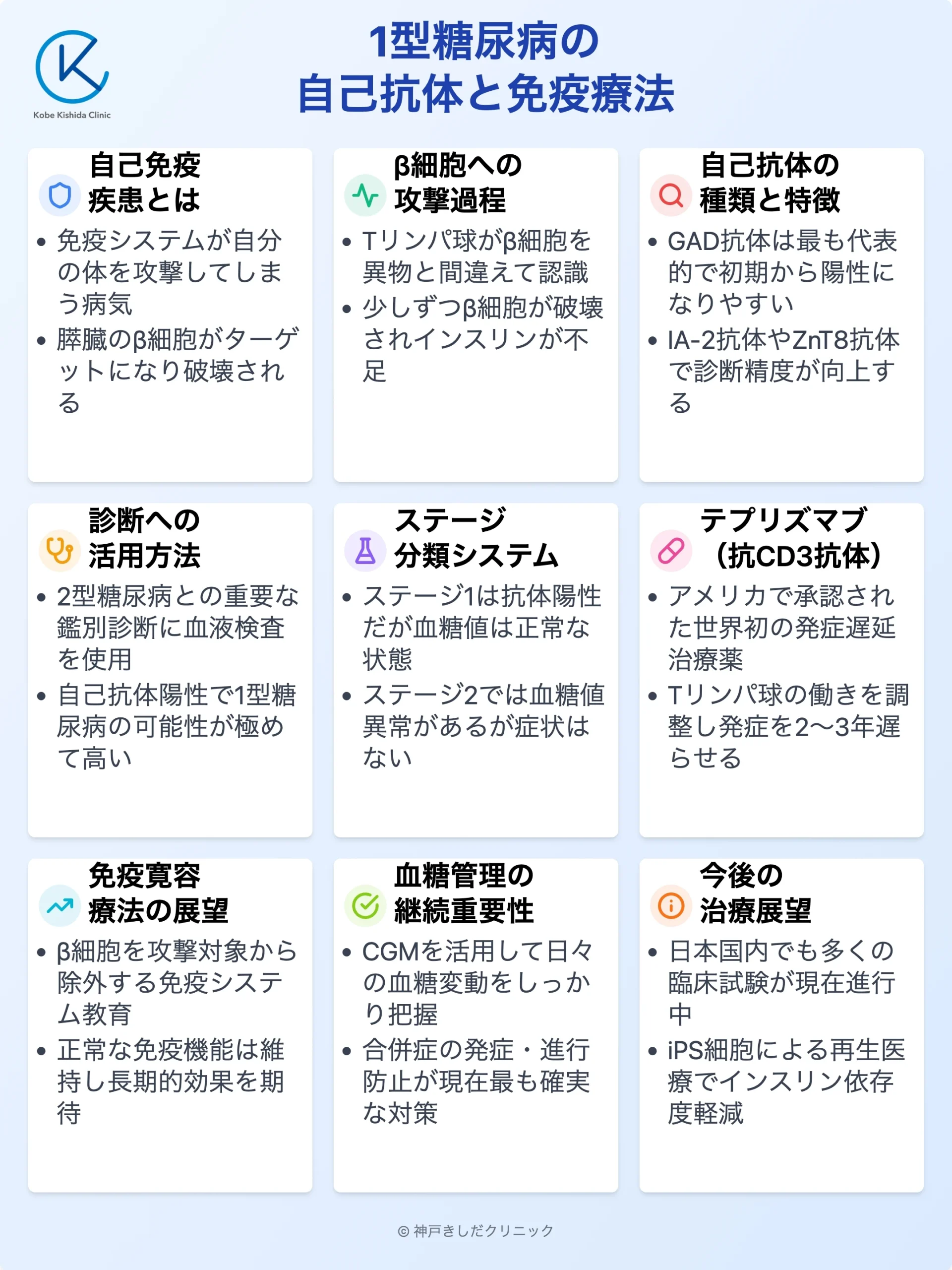
1型糖尿病はウイルスや細菌から体を守るはずの「免疫」が、誤って自分自身の体を攻撃してしまう「自己免疫疾患」の一つです。
体を守る免疫システムの誤作動
私たちの体には外部から侵入する異物を排除するための精巧な免疫システムが備わっています。
しかし、何らかのきっかけでこのシステムに異常が生じ、自分自身の正常な細胞や組織を「敵」と見なして攻撃を始めてしまうことがあります。これが自己免疫です。
主な自己免疫疾患の例
- 関節リウマチ
- 全身性エリテマトーデス
- 橋本病(慢性甲状腺炎)
- 1型糖尿病
攻撃の標的は膵臓の「β細胞」
1型糖尿病の場合、免疫システムが攻撃の標的とするのは膵臓の中にある「β細胞」です。
β細胞は血糖値を下げる唯一のホルモンである「インスリン」を産生し、分泌する非常に重要な役割を担っています。
免疫細胞(主にTリンパ球)がβ細胞を異物と誤認し、少しずつ破壊していきます。
インスリンが作れなくなる結果
β細胞が破壊されると体内でインスリンを十分に作ることができなくなります。
インスリンがなければ血液中の糖を細胞に取り込んでエネルギーとして利用することができず、血糖値が高いままになってしまいます。
この状態が1型糖尿病であり、生命を維持するためにはインスリンを体外から補充する治療が必須となります。

発症の鍵を握る「自己抗体」の正体
自己免疫の働きによって作られ、1型糖尿病の発症に深く関わるのが「自己抗体」です。
血液検査でこの自己抗体を調べることは診断において非常に重要です。
抗体と自己抗体の違い
「抗体」とは、ウイルスや細菌などの異物(抗原)が体内に侵入した際に、それに対抗するために作られるタンパク質です。
一方、「自己抗体」は免疫システムの誤作動により、自分自身の組織や細胞の成分(自己抗原)に対して作られてしまう抗体のことを指します。
抗体と自己抗体の比較
| 項目 | 抗体 | 自己抗体 |
|---|---|---|
| 攻撃対象 | ウイルス、細菌などの外敵 | 自分自身の細胞・組織 |
| 役割 | 体を守る(生体防御) | 体を傷つける(自己免疫疾患の原因) |
1型糖尿病に関連する主な自己抗体
1型糖尿病の患者さんでは、膵臓のβ細胞に関連する特定の自己抗体が検出されることが多くあります。
これらはβ細胞が破壊されている目印となり、診断の大きな手がかりとなります。
1型糖尿病で検出される主な自己抗体
| 自己抗体の種類 | 正式名称 | 特徴 |
|---|---|---|
| GAD抗体 | 抗グルタミン酸脱炭酸酵素抗体 | 最も代表的で、発症初期から陽性になることが多い |
| IA-2抗体 | インスリノーマ関連抗原2抗体 | GAD抗体と同時に測定することで診断精度が向上する |
| IAA | インスリン自己抗体 | 特に低年齢で発症する患者様で見つかりやすい |
| ZnT8抗体 | 亜鉛トランスポーター8抗体 | 他の抗体が陰性でも陽性になることがある |
自己抗体検査でわかること
血液検査でこれらの自己抗体の有無を調べることで、1型糖尿病であるかどうかの診断をより確実なものにします。
特に生活習慣病である2型糖尿病との区別が難しい場合に、この検査は非常に役立ちます。
自己抗体が陽性であれば、1型糖尿病の可能性が極めて高いと判断します。

1型糖尿病の診断とステージ分類
自己抗体の発見は1型糖尿病の診断を確定させるだけでなく、病気がどの段階にあるかを評価するためにも用いられます。
2型糖尿病との鑑別診断
典型的な若年発症の1型糖尿病とは異なり、成人してからゆっくりと進行するタイプ(緩徐進行1型糖尿病:SPIDDM)もあります。
このような場合、2型糖尿病と間違われやすいですが、自己抗体検査を行うことで正確に鑑別できます。この鑑別は、その後の治療方針を決定する上で非常に重要です。
発症前の段階(プレ1型糖尿病)
近年、1型糖尿病は血糖値が正常な段階から始まっていることが分かってきました。
自己抗体が存在するものの、まだ血糖値に異常がない状態を「ステージ1」、血糖値の異常は出始めたものの、まだ症状がない状態を「ステージ2」と分類します。
この段階で発見できれば、将来の発症を遅らせる治療(免疫療法)の対象となる可能性があります。
1型糖尿病のステージ分類
| ステージ | 自己抗体 | 血糖値 | 症状 |
|---|---|---|---|
| ステージ1 | 陽性 | 正常 | なし |
| ステージ2 | 陽性 | 異常あり | なし |
| ステージ3 | 陽性 | 異常あり | あり(発症) |
抗体があれば必ず発症するのか
いいえ、必ずしもそうではありません。
自己抗体を1種類だけ持っている場合、生涯で1型糖尿病を発症するリスクは15%程度とされています。
しかし抗体の種類が2種類、3種類と増えるにつれて発症リスクは著しく高まり、4種類すべてが陽性の場合は、数年以内にほぼ100%発症すると考えられています。

根本治療を目指す「免疫療法」とは
インスリン療法は失われたインスリンを補充する対症療法ですが、免疫療法は病気の原因である免疫システムの誤作動そのものを修正しようとする根本的な治療法です。
免疫システムの誤作動を止める
免疫療法の目的はβ細胞を攻撃している免疫細胞の働きを抑えたり、攻撃の指令を止めたりすることです。
このことにより、残っているβ細胞がそれ以上破壊されるのを防ぎ、インスリンを分泌する能力を維持、あるいは回復させることを目指します。
なぜただ免疫を抑えるだけでは不十分なのか
体全体の免疫を強力に抑制すると、β細胞への攻撃は止まりますが、同時に感染症に対する抵抗力も弱まってしまうという大きな問題があります。
そのため現在の研究ではβ細胞を攻撃する免疫反応だけをピンポイントで抑え、正常な免疫機能は維持するような、より安全で効果的な方法が模索されています。
「免疫寛容」という考え方
現在の免疫療法の主流は「免疫寛容」を誘導するという考え方です。
これは免疫システムに「β細胞は攻撃するべき敵ではない」と再び教え込み、β細胞を攻撃対象から外させる(寛容させる)というアプローチです。
これにより、長期的に安全な治療効果が期待できます。

世界で進む免疫療法の開発
1型糖尿病に対する免疫療法は世界中で活発に研究されており、一部はすでに実用化されています。
抗CD3抗体(テプリズマブ)
テプリズマブはβ細胞を攻撃するTリンパ球の働きを一時的に抑える薬剤です。
アメリカでは1型糖尿病の高リスク者(ステージ2)を対象に、発症を平均で約2~3年遅らせる効果が認められ、世界で初めて1型糖尿病の発症を遅延させる薬として承認されました。
発症直後の患者様に対する効果も研究されています。
テプリズマブ(抗CD3抗体)の概要
| 項目 | 内容 |
|---|---|
| 作用 | Tリンパ球の働きを調整し、β細胞への攻撃を抑制 |
| 対象 | 1型糖尿病の高リスク者(ステージ2) |
| 効果 | 発症を平均2~3年遅らせる |
抗原特異的免疫療法
これはβ細胞の成分(抗原)を少量ずつ投与することで、その抗原に対する過剰な免疫反応を鎮静化させ、免疫寛容を誘導しようとする治療法です。
アレルギー治療における減感作療法と似た考え方で、より安全性の高い治療法として期待されています。
細胞療法(CAR-T療法など)
患者さん自身の免疫細胞(T細胞)を一度体外に取り出し、遺伝子操作によってβ細胞を攻撃しないように性質を変えたり、逆に過剰な免疫を抑える働きを持つようにしたりしてから、再び体内に戻すという先進的な治療法です。
細胞療法はまだ研究段階ですが、根本治療に繋がる可能性を秘めています。

免疫療法の現状と今後の展望
多くの期待が寄せられる免疫療法ですが、実用化に向けてはいくつかの課題も残されています。
日本での実用化に向けて
アメリカで承認されたテプリズマブも日本ではまだ承認されていません(2025年7月現在)。国内でも臨床試験が行われており、早期の実用化が待たれます。
他の免疫療法についても多くの研究が進行中であり、今後の成果が期待されます。
治療の対象となる人
現在の免疫療法の主な対象は発症リスクの高い方(ステージ2)や、発症して間もない方です。これは、まだ多くのβ細胞が残っている段階で治療を始める方が効果を得やすいと考えられているためです。
長年1型糖尿病を患っている方に対する効果は、今後の研究課題です。
副作用と安全性の課題
免疫システムに働きかける治療であるため、頭痛や発熱、アレルギー反応などの副作用が起こる可能性があります。
また、長期的な安全性については今後も慎重にデータを蓄積していく必要があります。
治療のメリットとデメリットを十分に理解することが重要です。

1型糖尿病と向き合うために今できること
新しい治療法の登場が待たれる一方で、日々の自己管理がご自身の未来を守る上で最も重要であることに変わりはありません。
まずは日々の血糖コントロール
免疫療法が実用化されても、インスリン治療がすぐに不要になるわけではありません。良好な血糖コントロールを維持し、合併症の発症・進行を防ぐことが現在できる最も確実な対策です。
CGM(持続血糖測定器)などを活用し、ご自身の血糖変動を把握することが第一歩です。
正しい情報を得る重要性
インターネット上には様々な情報が溢れていますが、中には科学的根拠の乏しいものもあります。
新しい治療に関する情報は学会の発表や信頼できる医療機関のウェブサイトなどから得るようにし、不明な点は主治医に確認しましょう。
主治医や医療チームとの連携
1型糖尿病の治療は医師だけでなく看護師、管理栄養士、薬剤師など多くの専門家がチームでサポートします。
治療に関する悩みや不安、期待などを率直に話し、信頼関係を築きながら一緒に最適な治療法を見つけていくことが大切です。

よくある質問
1型糖尿病の自己抗体や免疫療法について、よくあるご質問にお答えします。
- Q自己抗体は一度陽性になると消えませんか?
- A
一般的に、一度陽性になった自己抗体が自然に陰性化することはまれです。
病気の活動性によって抗体の量(抗体価)が変動することはありますが、存在そのものがなくなることは少ないと考えられています。
- Q家族が1型糖尿病です。自分も抗体検査を受けるべきですか?
- A
ご家族に1型糖尿病の方がいる場合、いない方と比べて発症リスクは高まりますが、それでも発症するのは一部です。
抗体検査を受けるかどうかはご自身の不安の程度や、もし陽性だった場合にその結果をどう受け止めるかをよく考えた上で医師と相談して決めるのが良いでしょう。
研究目的で検査を募集している場合もあります。
- Q免疫療法はどこで受けられますか?
- A
現在、日本国内で保険診療として受けられる1型糖尿病の免疫療法はありません。
臨床試験(治験)として、特定の大学病院などの研究機関で実施されている場合があります。
治験への参加には様々な条件がありますので興味のある方は主治医に相談したり、臨床試験情報を公開しているウェブサイトで調べたりすることができます。
- Qインスリンが不要になる日は来ますか?
- A
多くの患者さんやご家族、そして私たち医療者が抱く大きな願いです。
免疫療法やiPS細胞などを用いた再生医療の研究は世界中で精力的に進められています。
すぐに実現するのは難しいかもしれませんが、研究の進歩により、将来的にはインスリンへの依存度を大幅に減らしたり、不要になったりする日が来る可能性は十分にあります。
以上

参考にした論文
BEDNAR, Kyle J. Therapeutic Approaches to the Treatment of Type 1 Diabetes. 2015. PhD Thesis. University of Cincinnati.
MA, Hui, et al. Autoantibodies-enemies, and/or potential allies?. Frontiers in Immunology, 2022, 13: 953726.
BECKER, Niels-Peter, et al. Cardiomyopathy—An approach to the autoimmune background. Autoimmunity reviews, 2017, 16.3: 269-286.
POLLAK, T. A., et al. Prevalence of anti-N-methyl-d-aspartate (NMDA) receptor antibodies in patients with schizophrenia and related psychoses: a systematic review and meta-analysis. Psychological medicine, 2014, 44.12: 2475-2487.
GAUDIN, Olivier, et al. Gliptin accountability in mucous membrane pemphigoid induction in 24 out of 313 patients. Frontiers in Immunology, 2018, 9: 1030.
AUCOUTURIER, Françoise; INGEN, Saskia. Gliptin Accountability in Mucous Membrane Pemphigoid Induction. Autoantibodies, 2019, 451214.
MALLAH, Khalil, et al. Anti-inflammatory and neuroprotective agents in clinical trials for CNS disease and injury: where do we go from here?. Frontiers in immunology, 2020, 11: 2021.
WANG, Julia Y., et al. An autoantigen atlas from human lung HFL1 cells offers clues to neurological and diverse autoimmune manifestations of COVID-19. Frontiers in immunology, 2022, 13: 831849.
LEE, Ikjae, et al. Minimal manifestation status and prednisone withdrawal in the MGTX trial. Neurology, 2020, 95.6: e755-e766.